三年来,新冠疫情对各行各业造成冲击,也成为影响医药行业的重要因子。美国FDA一方面审批新药上市,另一方面又进行药品生产的监管检查,三年间亦有起伏跌宕。本文梳理一些变化,以供借鉴。
1.新药审批:节奏放缓
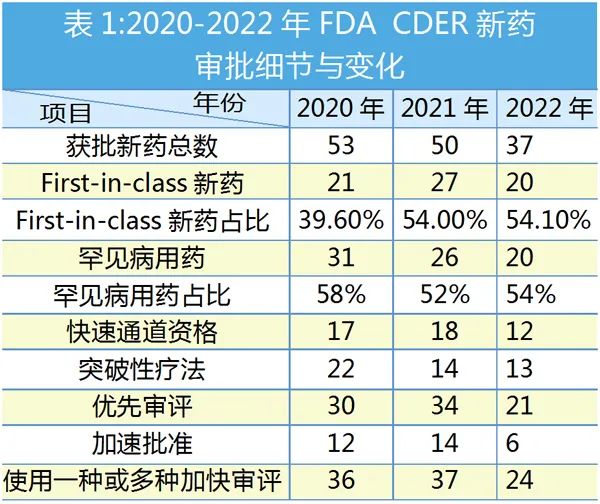
2020-2022年,FDA批准新药数量逐年减少,但“First-in-class”疗法递升,在此不对获批新药一一列举,仅简要分析逐年重要获批看点。
2020年:获批数量可观罕见病疗法近六成
2020年FDA CDER面临前所未有的挑战,但CDER共批准了53个新药,是20年来仅次于2018年的59款的第二高位。
53个新药中,有31个(58%)获批用于治疗影响20万或更少美国人的罕见或“孤儿”疾病,是这三年中数量与占比最高的一年。
在美国,罕见疾病患者通常很少或根本没有可治疗疾病的药物。当年获批罕见病新药应用范围囊括狼疮型肾炎、活跃性still病、遗传性血性水肿、库欣病、嗜酸性细胞增多症等;包括多发性骨髓瘤、神经母细胞瘤、慢性粒单核细胞白血病、骨髓增生异常综合征、胃肠道间质瘤、上皮样肉瘤和转移性胆管癌等罕见癌症;还有早年衰老症候群和早衰样核纤蛋白病等其他罕见病。
其中,Evrysdi(risdiplam)用于治疗2个月及以上脊髓性肌萎缩症(SMA)患者,是一种罕见且通常致命的遗传性疾病,影响肌肉力量和运动。也是FDA批准的第三种SMA治疗方法,但是唯一获批的口服SMA治疗方法;Lampit(尼非莫司)片剂获得加速批准,成为首个用于治疗恰加斯病年龄小于2岁(从出生到18岁以下,体重至少2.5公斤)儿科患者的疗法;Orladeyo(berotralstat)用于治疗遗传性血管性水肿患者,这是一种反复发作的严重肿胀(血管性水肿),最常见于四肢、面部、肠道和呼吸道的罕见疾病。
值得一提的是,这一年CDER批准了美国首个用于治疗COVID-19(住院成人和青少年)患者的药物。
2021年:推出可互换生物类似药癌症领域出爆款
2021年,FDA CDER共批准了50个新药。这一年,CDER采取了重要措施来推进糖尿病患者的治疗选择,批准了多个糖尿病药物。Semglee(甘精胰岛素-yfgn)注射剂和Rezvoglar(甘精胰岛素-aglr)注射剂分别被批准为Lantus(甘精胰岛素)的可互换生物类似药和生物类似药。
值得注意的是,Semglee是2021年CDER批准的头两个可互换生物类似药中的一个,另一个是Humira的可互换生物类似药Cyltezo。它们可以在药房替换参照品,而不受州法律的约束,类似于仿制药替换品牌药的方式。
2021年也是炎症性肠病(IBD)或涉及消化道炎症疾病治疗药的重要一年。FDA批准了一个针对中度至重度活动性溃疡性结肠炎成人患者的治疗药,这是IBD的一种,结肠内壁发炎并形成微小的开放性溃疡。2021年FDA继续推进治疗和预防HIV-1感染,批准多个HIV-1感染用药。
在神经和精神疾病方面,FDA批准了两个治疗药在紧急情况下逆转阿片类药物过量。使用加速批准途径批准了一个新药来治疗阿尔茨海默病,即备受争议的Aduhelm。
2021年是美国国家癌症法案实施50周年,该法案是致力于抗击癌症的具有里程碑意义的立法。在这个纪念年,CDER批准了多种针对不同癌症的治疗,包括4个用于非小细胞肺癌的新药和首个获批用于食道(食道相关)癌、胃癌和胃食管交界处(GEJ)腺癌一线治疗的免疫疗法、1个用于早期三阴性乳腺癌,或对针对HER2蛋白受体的激素疗法或药物治疗无反应的癌症的治疗药等。
2022年:获批数量较少创新药物占比最高
过去10年里,CDER平均每年批准43款新药,但2022年CDER批准的37款新药低于平均数,一度引发市场担忧。不过,20款“First-in-class”疗法占全年获批新药总数的54.1%,是三年来的最高值。
2.现场检查:频次增多
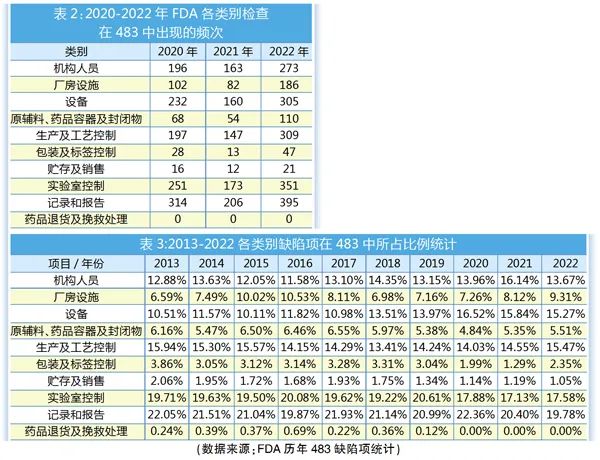
FDA483报告(缺陷报告),也称现场观察报告(Inspectional Observation), 是FDA检查官根据cGMP规范,对医药企业的质量体系进行现场检查过程中所发现的不符合cGMP之处列出的总结清单。2020-2022年,FDA各类别检查在483中出现的频次如表2所示。
由于新冠疫情,导致FDA近3年来检查数量明显减少,因此将时间线拉长,汇总2013-2022年FDA 483年度审计缺陷列表,并将分析基于各类别缺陷项在所有缺陷项中所占的比例,以剔除检查数量的影响,客观反应各类别缺陷项在历年中的比例变化,从而直观反映FDA近年来检查关注点的变化。
设备类缺陷项所占比例近年来有明显升高趋势,相比之下,包装及标签控制、贮存及销售、药品退货及挽救处理类有降低趋势。
(来源:医药经济报)