为贯彻落实《中华人民共和国药品管理法》和《中华人民共和国疫苗管理法》,2021年,国家药监局根据《药品质量抽查检验管理办法》等有关要求,以习近平总书记“四个最严”为根本指南,坚持问题导向和风险控制原则,组织各省级药品管理部门与相关检验机构,在全国范围内对部分生产、经营、使用、进口等环节的药品质量开展抽查检验工作,评估上市后药品的质量状况,打击制售假劣药品行为。通过加强顶层制度体系构建,整合抽检资源、以信息化引领监管现代化,不断促进抽检成果运用向纵深推进,积极提升服务药品监管效能。2021年国家药品抽检结果显示,当前我国药品安全形势总体平稳可控,药品质量持续保持在较高水平。
一、概述
药品抽检作为药品上市后监管的重要手段之一,是实现风险管理、科学监管的重要技术支撑。多年来,在打击违法违规行为、震慑不法企业、评价药品质量状况、提升行业标准、警示公众用药安全、服务智慧监管等方面发挥着重要作用。
国家药品抽检作为一个全国上下联动的协作项目,由国家药品监督管理部门统筹组织,采取“分散抽样、集中检验、探索研究、综合评价”的工作模式。2021年,国家药监局进一步优化品种遴选机制,聚焦群众关切,重点遴选临床使用量大、日常监管发现问题多的品种,同时配合基本药物、集中采购、进口检验等国家重大医药政策制定抽检计划及实施方案。在抽样环节采取分级抽样模式,由各省级药品监管部门组成的组织管理和监管保障体系,由全国31
个省(自治区、直辖市)和新疆生产建设兵团负责抽取样品;在检验研究环节遵循依标准检验和探索性研究并重的模式,由中国食品药品检定研究院等47个承检机构组成的技术支撑体系,对抽检样品进行深度“体检”,并紧盯突出问题,结合监管需求开展有针对性的探索性研究,不断提升探索性研究与风险挖掘的准确性,建立以问题为导向的质量分析研究体系,揭示可能存在的质量安全隐患,提升抽检服务监管的效能;同时完善风险分级防控机制,对发现的问题随时报告、随时研判、随时处置。目前已逐渐构建了基于全国药品抽检信息平台的智慧化信息管理系统,实现全过程实时动态管理,保障整个国家药品抽检政策的执行流程清晰明确。
2021年国家药品抽检共完成139个品种17856批次制剂产品与中药饮片的抽检任务,样品来源涉及3684家药品生产、经营企业和使用单位,覆盖境内31个省区市和新疆生产建设兵团,由47个药品检验机构承担检验和探索性研究任务。对检出的70批次不符合规定产品,国家药监局组织各省级药品监管部门采取相应的风险控制措施。
针对探索性研究发现的问题线索,国家药监局在风险分析研判的基础上,实施以“检监结合”为重点的分级监管。对可能存在安全隐患的产品,及时部署采取相应的风险控制措施;对个别涉嫌存在违法违规问题的企业,组织监管部门开展现场检查;对一般性问题,采取风险提示等措施督促相关企业排查整改。
二、抽检数据分析
(一)抽样情况
2021年国家药品抽检共抽取制剂产品与中药饮片品种139个,包括化学药品81个、中成药46个、中药饮片9个、生物制品3个,其中国家基本药物品种53个;共抽检样品17856批次,包括生产环节3965批次、经营环节12409批次、使用环节1250批次和口岸环节232批次(见图1),涉及1113家药品生产企业、2085家药品经营企业和486家药品使用单位,各省(区、市)样品抽取情况以及所抽取样品的标示生产企业所在地区抽样分布情况,分别见图2与图3。
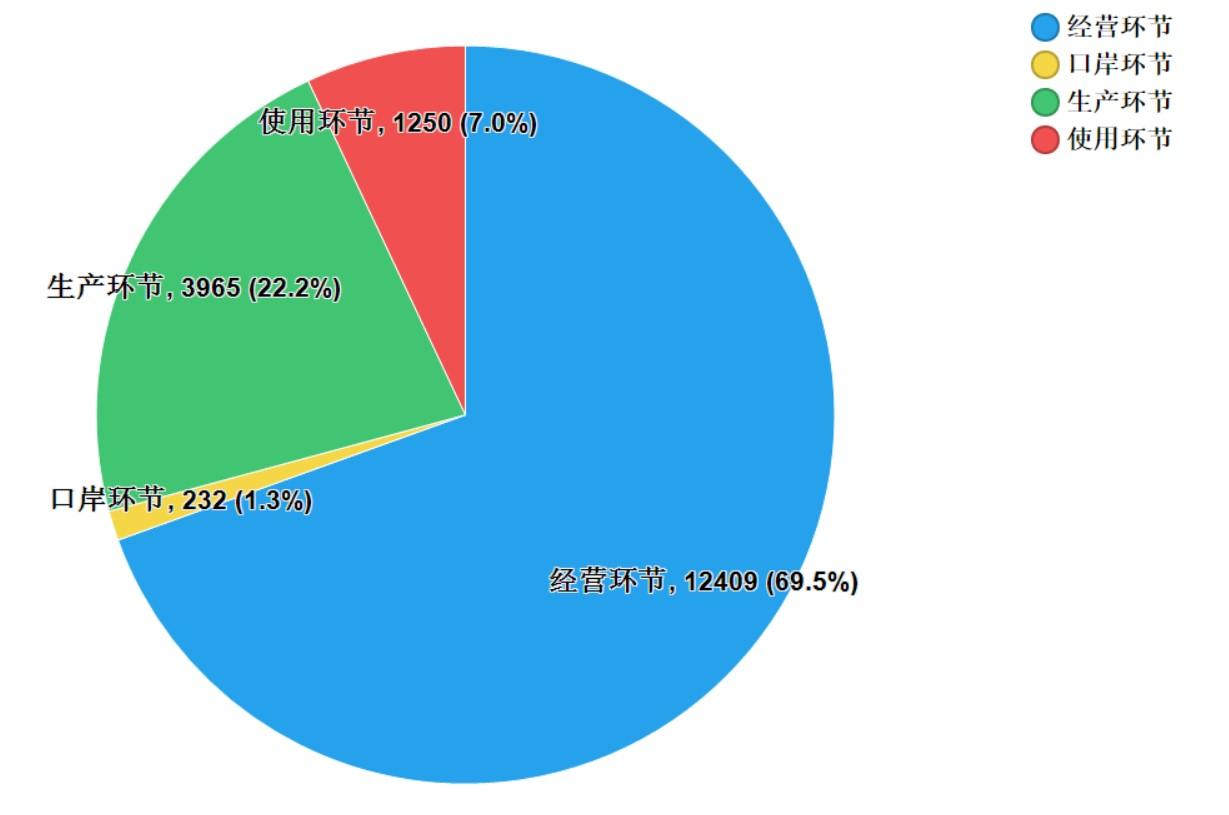
图1.各抽样环节抽样情况
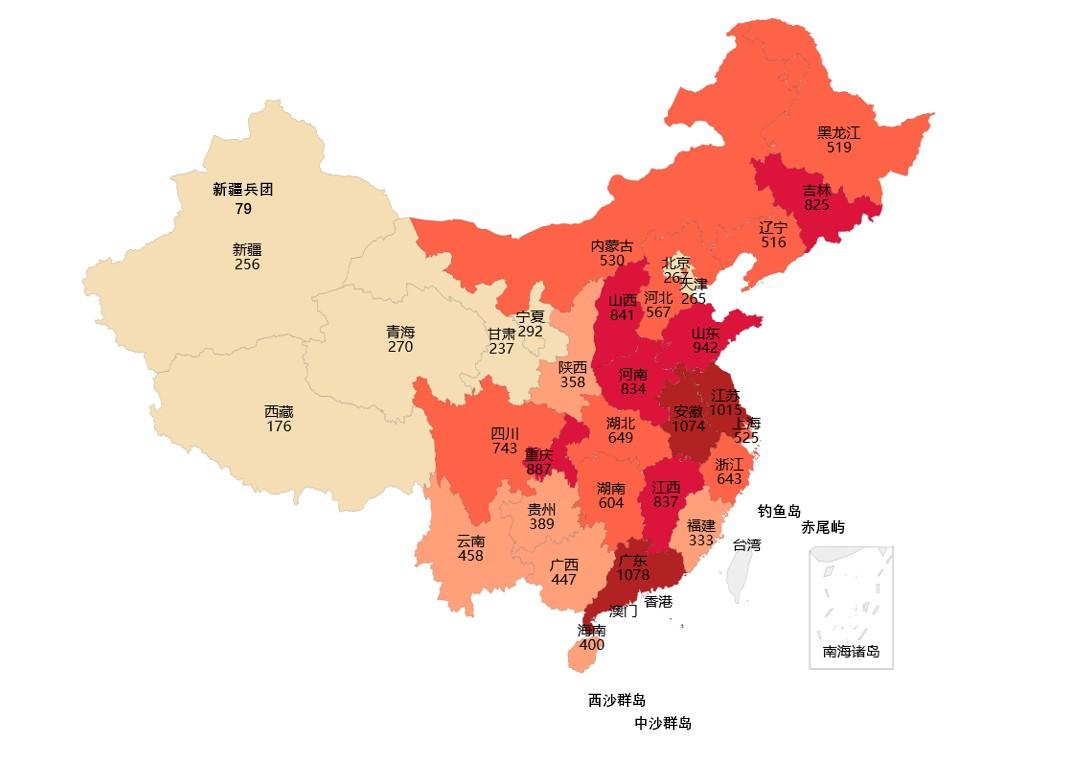
图2.抽检样品来源分布图
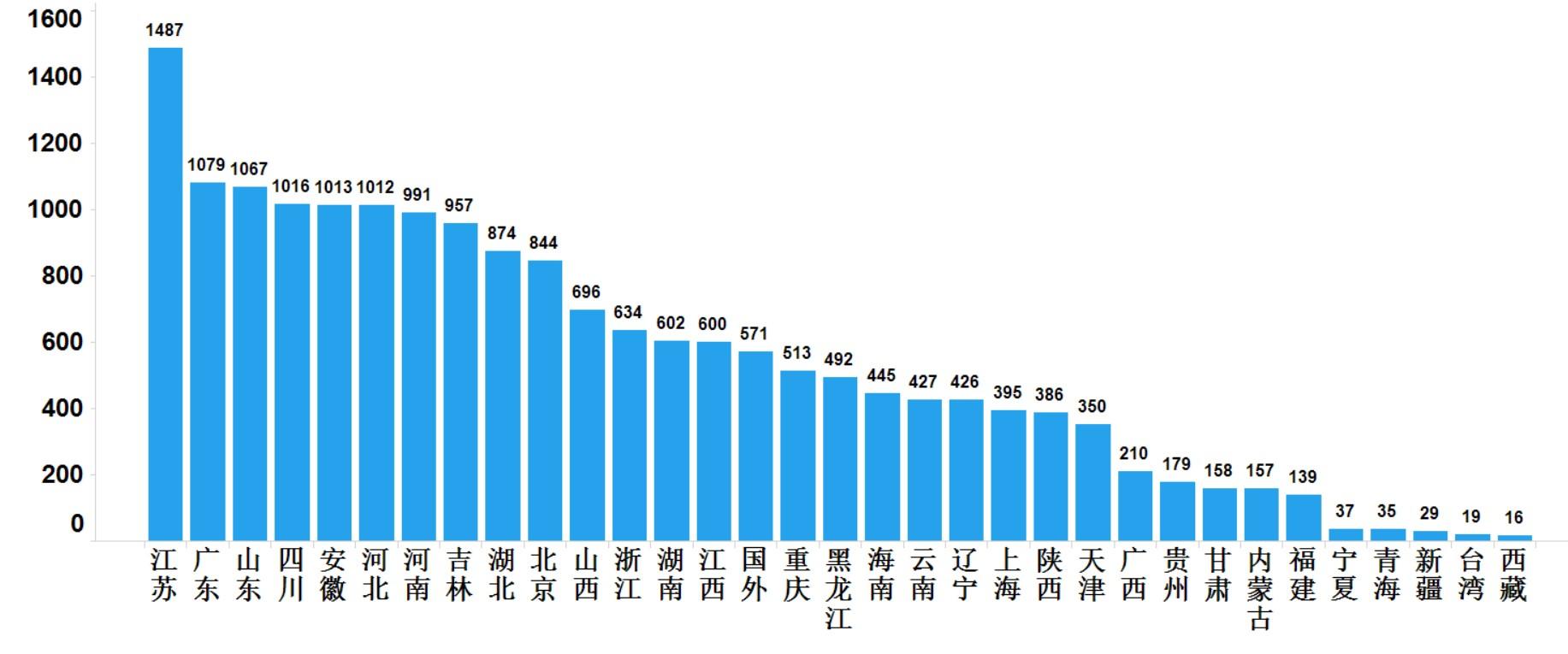
图3.抽检样品产地分布图
(二)药品制剂抽检数据分析
2021年国家药品抽检共抽检制剂产品15899批次。经检验,15861批次产品符合规定,38批次产品不符合规定。抽检的130个品种中,全部样品符合规定的制剂产品有108个,共12419批次。其中,化学药品有70个品种7674批次,中成药有35个品种4681批次,生物制品有3个品种64批次。
1. 化学药品
2021年国家药品抽检共抽检化学药品81个品种9455批次,涉及生产环节1769批次、经营环节6577批次、使用环节877批次、口岸环节232批次。经检验,不符合规定18批次,在生产、经营、使用、口岸环节分别检出不符合规定产品2批次、16批次、0批次和0批次,分别占对应环节全部样品的0.1%、0.2%、0.0%、0.0%(见图4)。
2021年国家药品抽检共涉及16个剂型,共有5个剂型存在不符合规定产品。其中,片剂(7批次)、胶囊剂(6批次)、乳膏剂(3批次)、眼用制剂(1批次)、口服溶液剂(1批次),分别占对应剂型全部样品批次的0.2%、0.6%、1.4%、0.5%、0.6%(见图5)。
不符合规定项目包括性状、鉴别、检查和含量测定,不符合规定产品数量依次为1、4、14和2批次,分别占全部不符合规定项目的4.8%、19.0%、66.7%和9.5%(见图6)。
抽检数据显示,经营环节出现不符合规定情况高于生产环节,不符合规定项目中检查项占比最大,涉及“有关物质”、“溶出度”等检验项目,不符合规定原因主要与生产工艺中压片强度、原辅料混合程度、运输储存过程中的温度影响等相关因素有关。
抽检结果提示,生产企业应严格原料入厂检验,提高生产工艺稳定性、优化关键质量参数控制,重点关注乳膏剂、口服溶液剂等剂型品种,对检查项目及检验指标反映的问题予以深入研究;经营企业应加强药品储存、运输过程管理,完善温湿度监控体系,重点关注需要阴凉、冷藏储存等特殊条件保存的药品;建议监管部门严格审查企业批生产记录,核查原辅料投料量,推动质量标准提升。
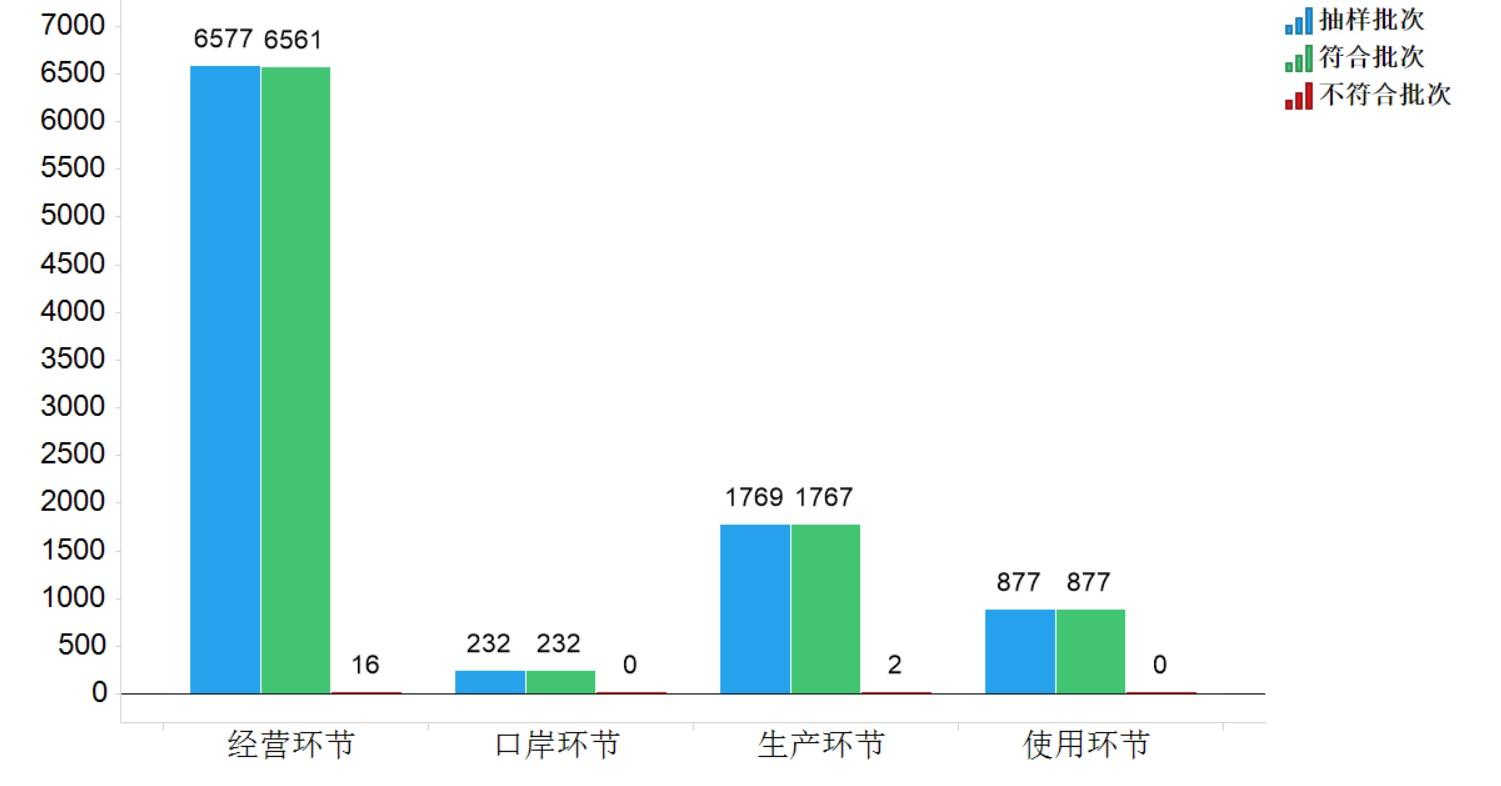
图4.化学药品各抽样环节检验信息示意图

图5.化学药品各剂型检验信息示意图
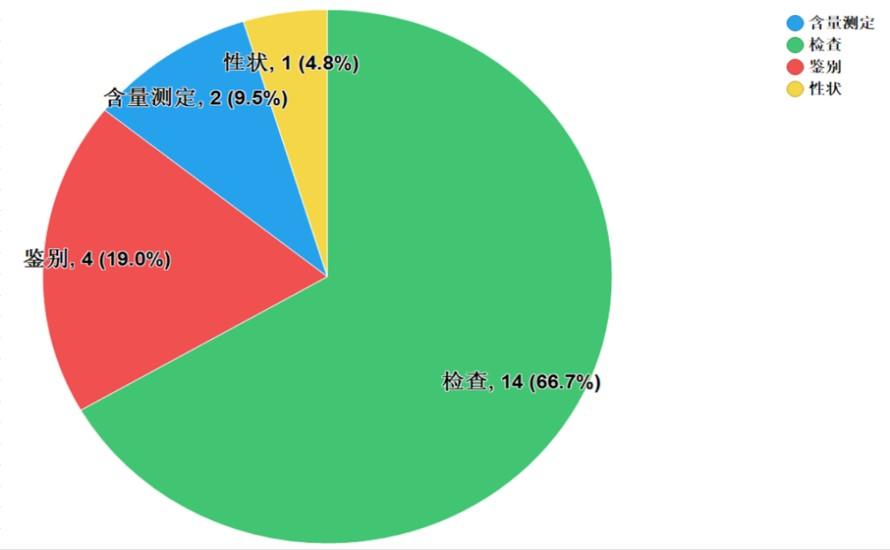
图6.化学药品不符合规定项目分布图
注:某些不符合规定产品涉及多个不符合规定项目。
2. 中成药
2021年国家药品抽检共抽检中成药46个品种6380批次,涉及9个剂型,在生产、经营和使用环节各抽取样品1417批次、4914批次、49批次。经检验,符合规定6360批次,不符合规定20批次,分别在生产与经营环节检出不符合规定产品2批次和18批次,分别占对应环节全部样品的0.1%和0.4%(见图7)。
不符合规定项目主要涉及鉴别、检查、含量测定等,不符合规定样品批次依次为9批次、7批次和4批次,分别占全部不符合规定项目的45.0%、35.0%和20.0%(见图8)。
不符合规定产品主要涉及6个剂型,包括散剂(8批次)、贴膏剂(4批次)、胶囊剂(3批次)、丸剂(2批次)、糖浆剂(2批次)、片剂(1批次),分别占对应剂型全部样品的5.8%、0.5%、0.2%、0.2%、0.4%、0.1%(见图9)。其中散剂不符合规定批次占比最高,不符合规定项目为鉴别项。
抽检结果提示,药品生产企业应强化主体责任意识,严把原药材质量关,从源头提高产品投料用原料药材的质量,加强工艺参数优化,严格按照工艺规程生产,提高产品质量的均一性和稳定性。
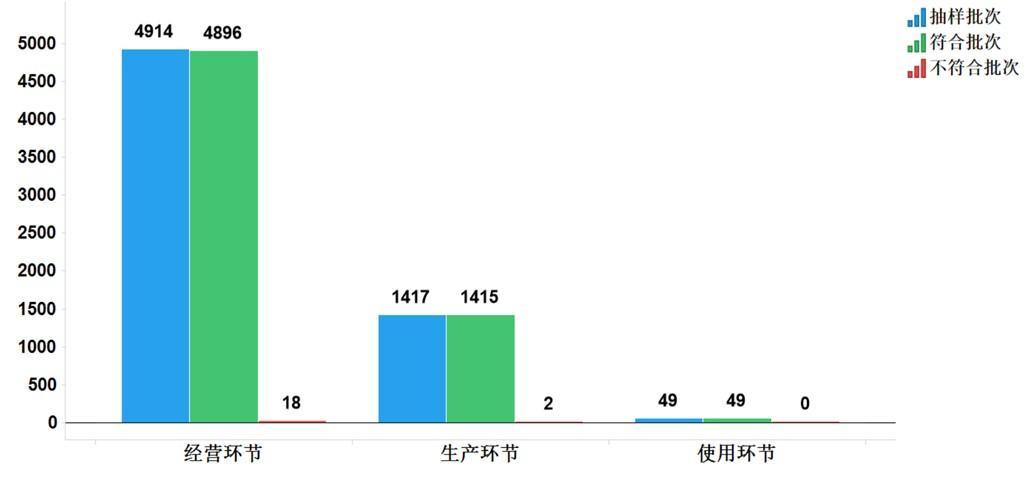
图7.中成药各抽样环节检验信息示意图
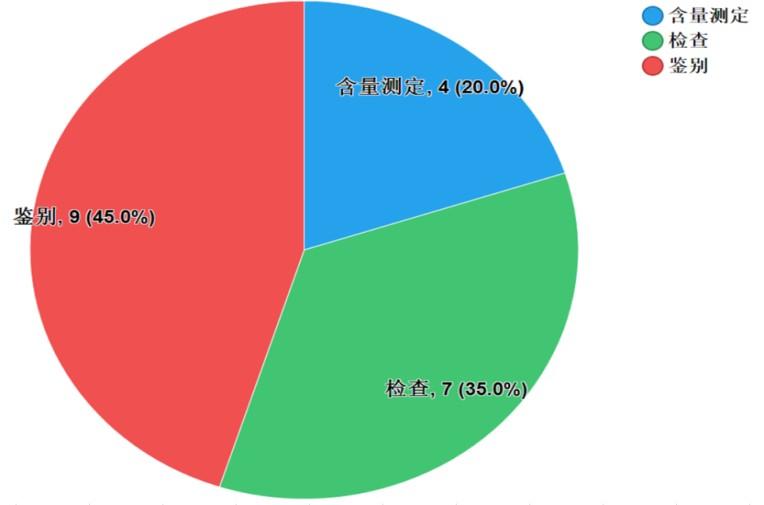
图8.中成药不符合规定项目分布图

图9.中成药各剂型检验信息示意图
3. 生物制品
2021年国家药品抽检共抽检生物制品3个品种64批次,其中生产、经营、使用环节分别抽取43批次、20批次、1批次。涉及治疗类品种2个,预防类品种1个,剂型均为注射剂(见图10)。经检验,所检项目均符合规定,合格率为100%。
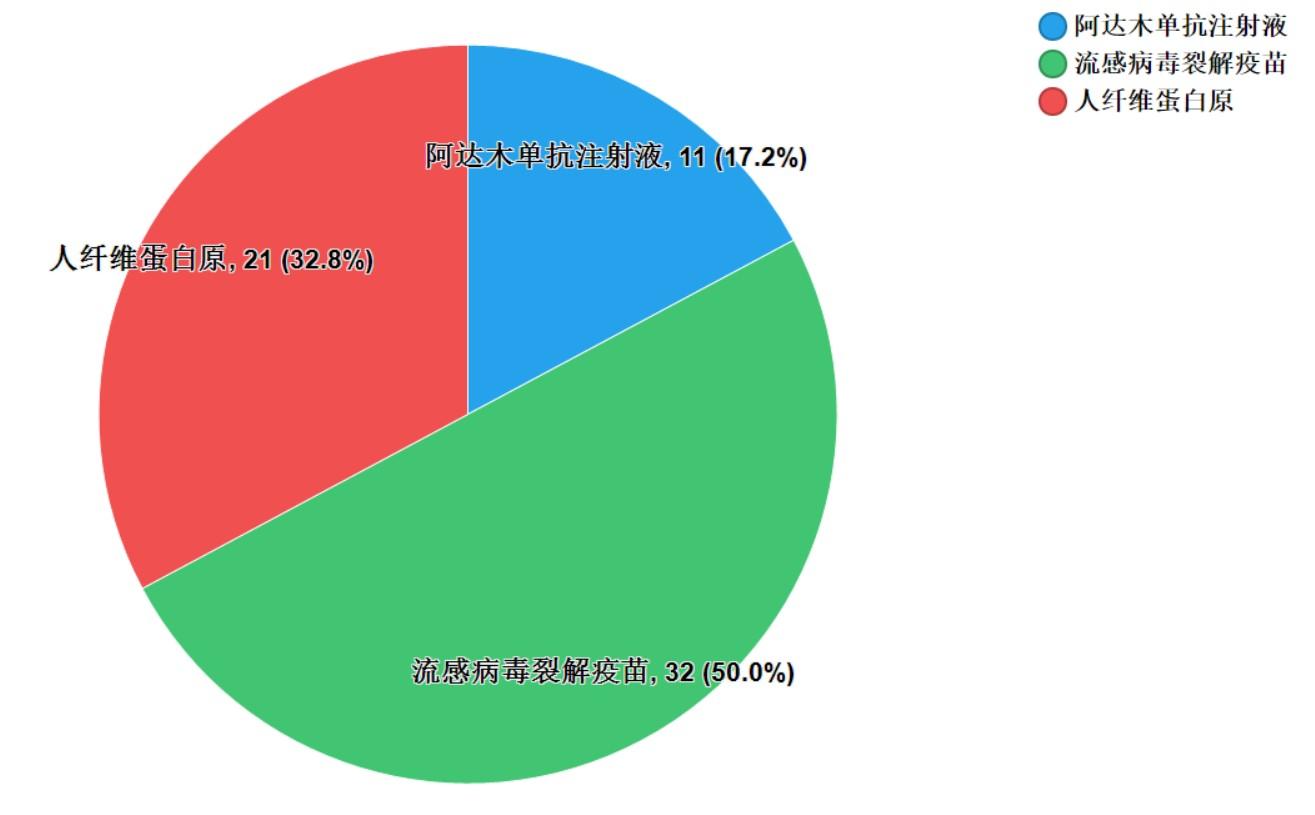
图10.生物制品抽检品种信息示意图
4. 国家基本药物
2021年国家药品抽检共抽检基本药物(不含中药饮片)44个品种6186批次,在生产、经营和使用环节各抽取样品1193批次、4562批次和431批次。经检验,不符合规定6批次,分别在生产与经营环节检出不符合规定产品1批次和5批次,涉及4个剂型。抽检结果显示,国家基本药物整体质量状况较好(见图11、12)。
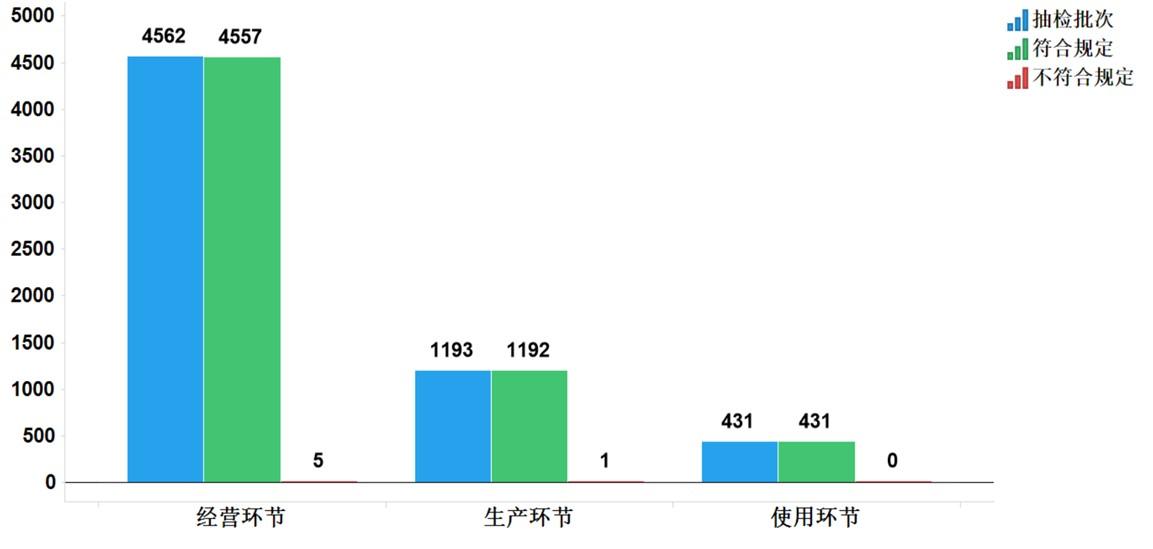
图11.国家基本药物各抽样环节检验信息示意图
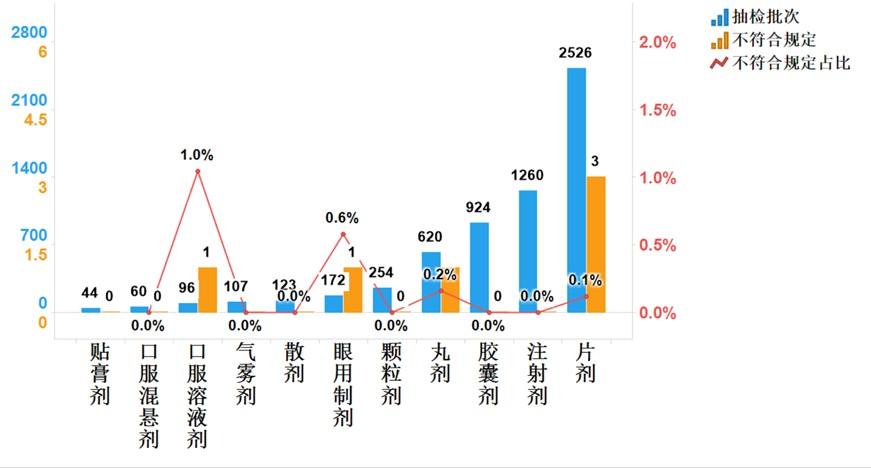
图12.国家基本药物各剂型检验信息示意图
5.进口药品(不含进口中药材)
2021年,国家药品抽检共抽检进口药品590批次,涉及4个剂型(见图13),其中口岸环节232批次、生产环节14批次、经营环节288批次、使用环节56批次(见图14)。经检验,所检项目均符合规定,合格率为100%。
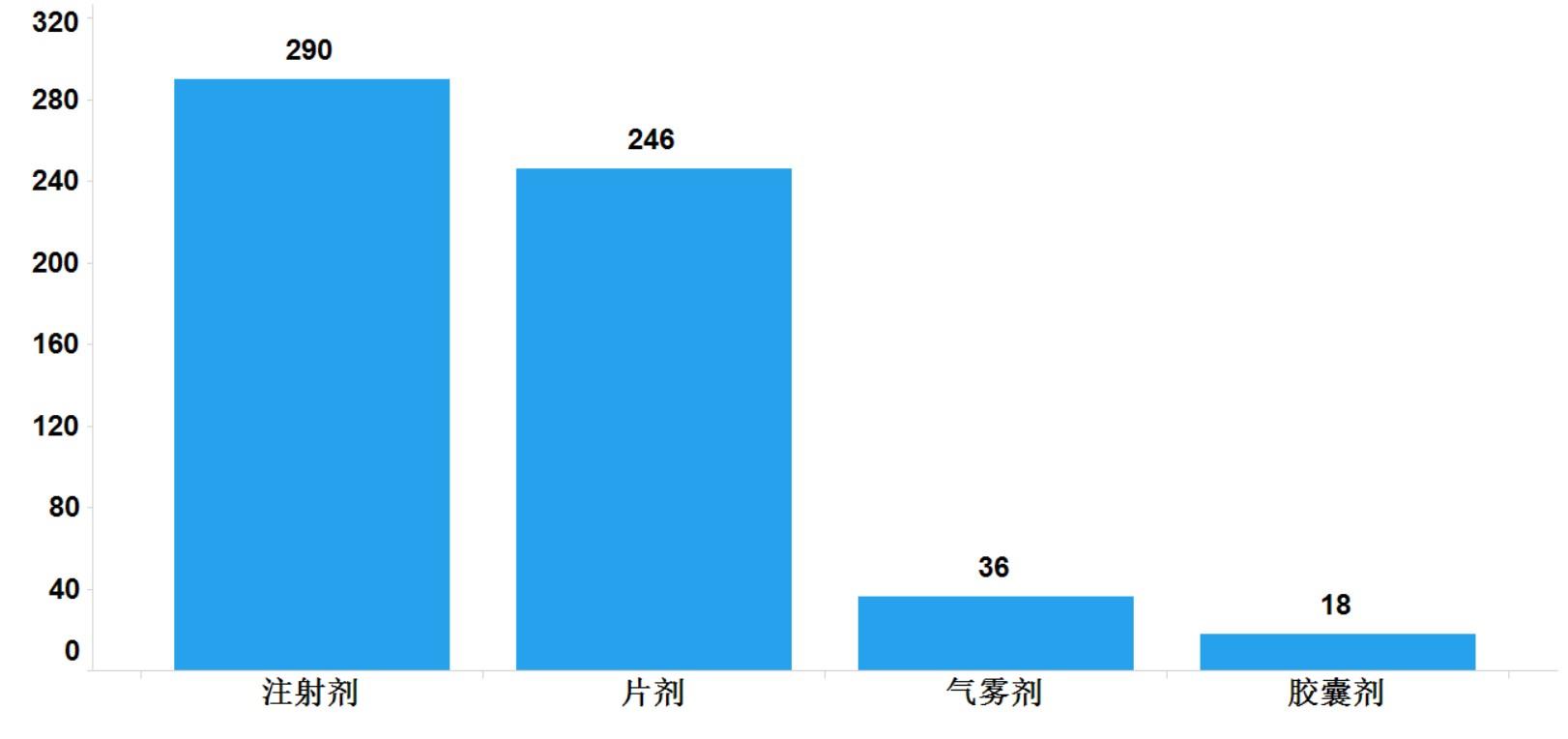
图13.进口药品各剂型与抽样环节检验信息示意图
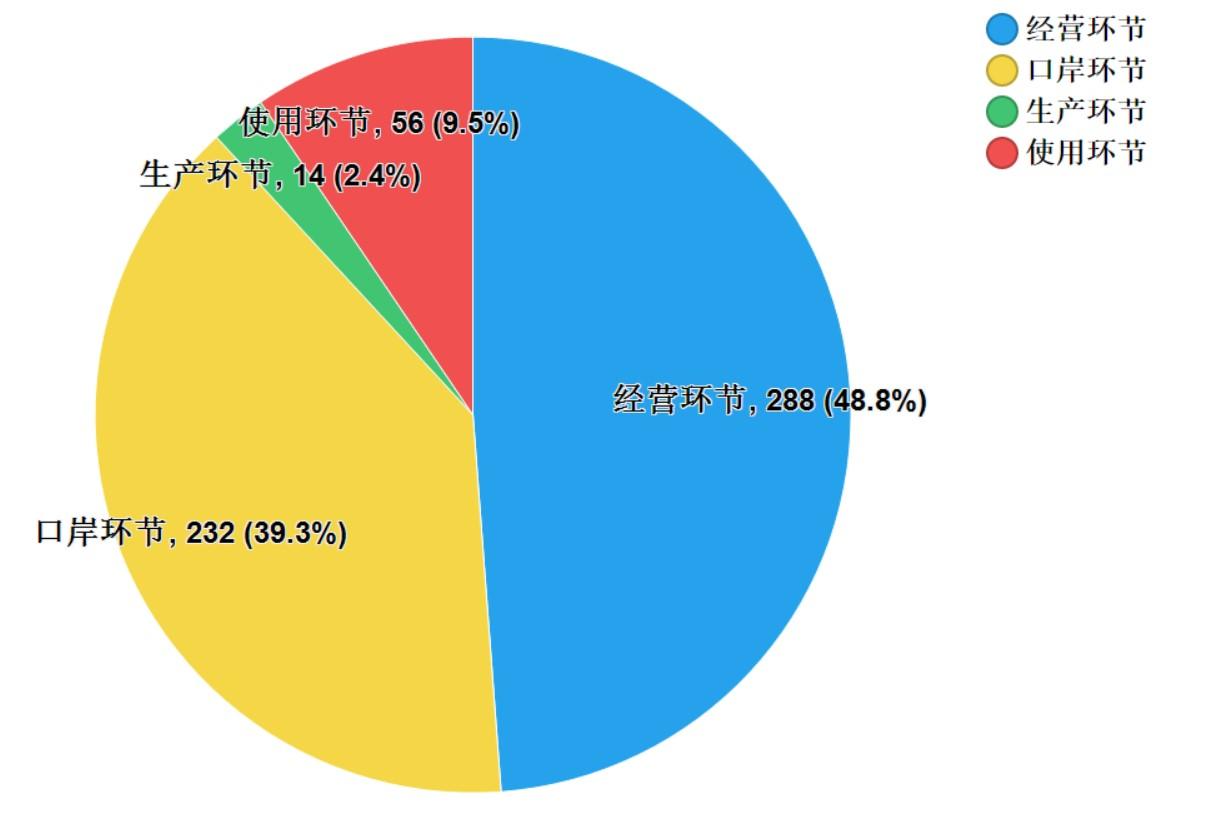
图14. 进口药品各抽样环节检验信息示意图
(三)中药饮片专项抽检及中药材质量监测情况
2021年,为贯彻落实《中华人民共和国药品管理法》和《中华人民共和国中医药法》,国家药监局组织开展了中药饮片专项抽检及中药材质量监测工作,组织对部分药品生产企业、药材市场集散地或种植集中区的中药材质量进行监测。
2021年中药饮片专项抽检共抽检9个中药饮片品种1957批次,主要针对中药饮片的安全性方面(如掺假掺伪、违法染色),以及质量控制(如生产规范性、专属性、二氧化硫、重金属及农残)等方面开展检验和探索性研究。经检验,符合规定1925批次,不符合规定32批次(见图15)。不符合规定项目主要涉及总灰分(2批次)、性状(18批次)、杂质(11批次)、鉴别(1批次)和含量测定(3批次)等方面,分别占全部不符合规定项目的5.7%、51.4%、31.4%、2.9%和8.6%(见图16)。2021年中药材质量监测共抽取9个品种378批次样品,其中,药品生产企业264批次,市场集散地或种植集中区114批次。所有样品按照不同品种特点,针对相应项目进行了研究性检验,主要针对掺杂掺伪、加工炮制规范、农药残留、植物生长调节剂使用等问题开展。
2021年中药饮片专项抽检及中药材质量监测发现的主要问题有:一是混伪品代用、掺杂问题,如藏柴胡冒充柴胡、关苍术及杂交苍术掺伪冒充苍术、苋菜子掺伪青葙子等;二是外源性有害物质残留超限问题,部分原料存在真菌毒素污染、农药残留污染、重金属及有害元素超标等隐患,如个别批次苍术、木香重金属残留,个别北沙参检出植物生长调节剂;三是采收加工与加工炮制不规范问题,如苍术由于产地加工泥土去除不完全,个别样品总灰分超过标准限度,柴胡饮片加工过程中地上茎过多导致非药用部位杂质超标。
抽检结果及监测结果提示,我国中药材及饮片总体质量状况良好。中药饮片生产企业应提高质量控制意识,严格遵照质量标准及炮制规范要求执行;应重视中药材种植源头控制质量安全问题,规范种植并加强生产各环节质量管理,加强对药材采收后、饮片炮制加工前的药材供货商环节的质量把控,重视贮存环节管理,重点关注掺伪、有害物质残留等问题;加强药材溯源管理,督促药品生产企业强化质量管理意识;强化药材市场监测,建立健全药材质量长效监测机制,保证药材流通质量。
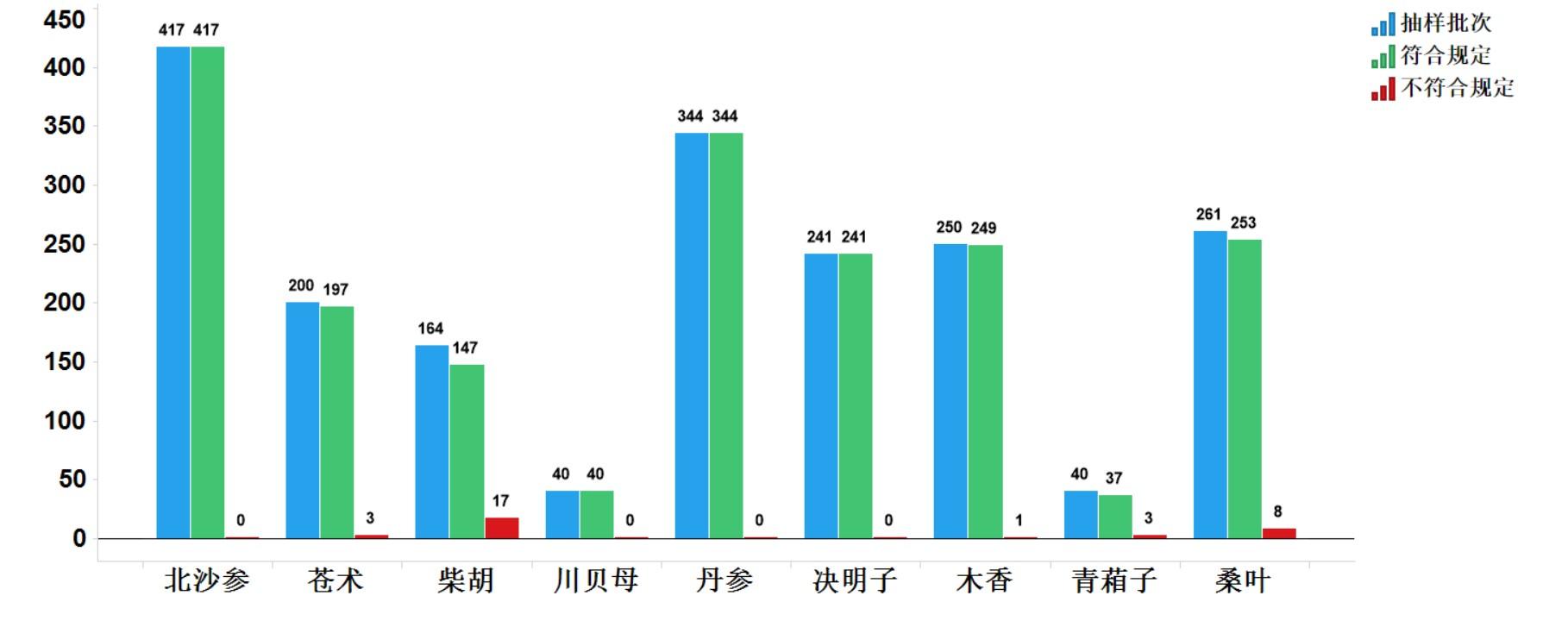
图15.2021年中药饮片专项抽检结果示意图
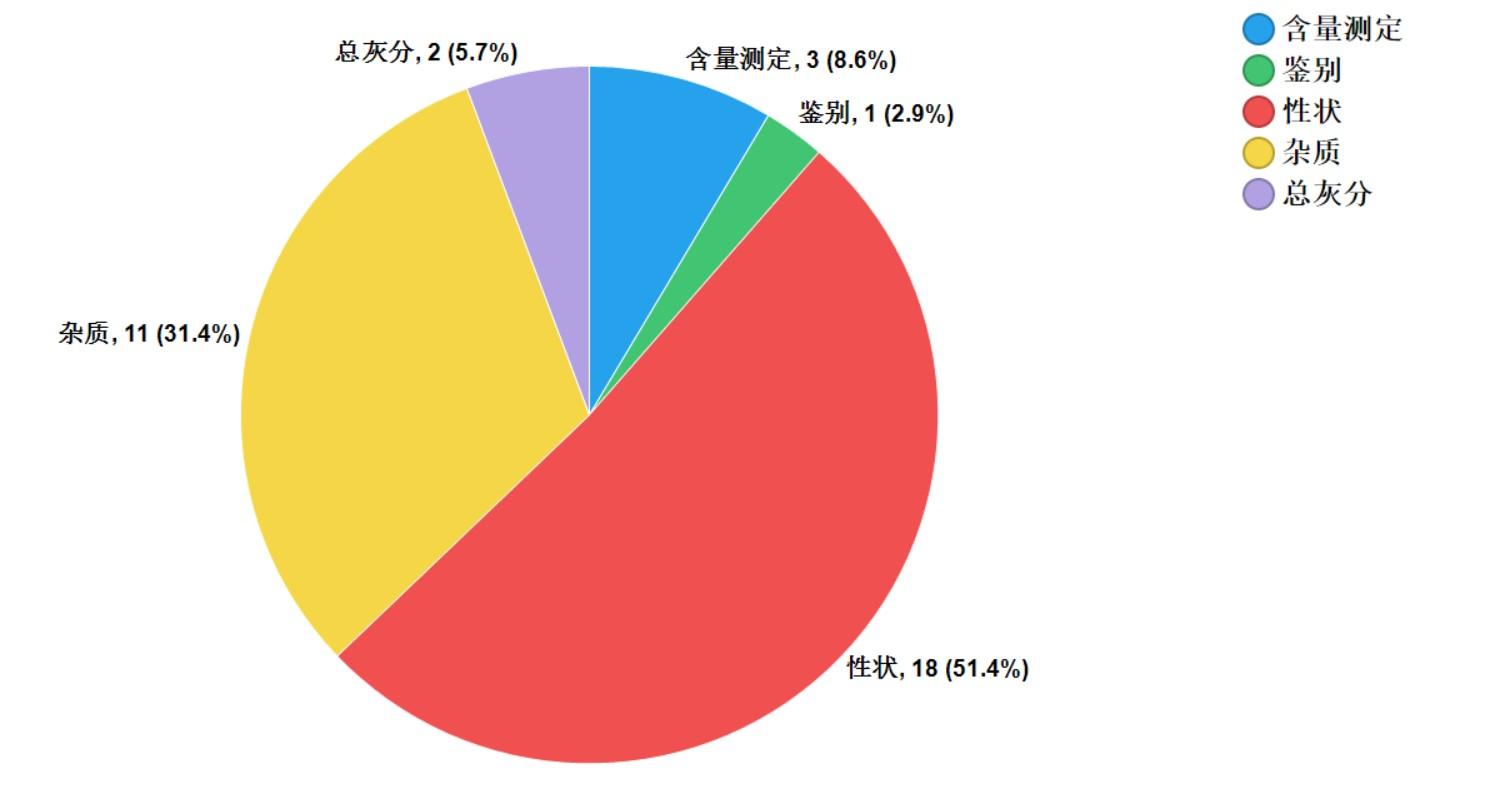
图16. 2021年中药饮片专项不符合规定项目分布图
注:某些不符合规定产品涉及多个不符合规定项目。
(四)探索性研究
2021年,各药品检验机构在按照现行法定标准检验的基础上,围绕抽检品种可能存在的安全性、有效性问题,开展有针对性的探索性研究,发现的主要问题有:
一是个别企业违法违规生产问题仍然存在,如擅自改变生产工艺,低限或使用掺伪、替代品投料,违反关键工艺制法,擅自改变或添加辅料、防腐剂和抑菌剂等;二是不同厂家因原料药质量差异、生产工艺不稳定等原因,导致产品均一性较差;三是中药饮片混用掺伪问题,如使用质量低劣、掺伪的中药材及饮片生产中药成方制剂;四是外源性污染物超限,部分品种重金属、农药、防腐剂残留量超限;五是包装材料相容性问题影响产品质量稳定性。
三、抽检结果应用
药品抽检是药品上市后监管的主要技术手段,也是实现科学监管、智慧监管的重要技术支撑。2021年,随着国家药品抽检制度体系的不断优化创新,国家药品抽检的风险防控能力不断提升、风险防控关口不断前移。药品监管部门充分利用国家药品抽检结果,通过有效识别风险、多措并举打出监检结合“组合拳”,在震慑不法企业、打击违法违规、提升药品质量、以及评价药品质量状况、警示公众用药安全等方面发挥了重要作用,正逐步从服务监管的技术手段向服务监管、服务产业、服务公众的多维度技术支撑方向扩展。
(一)维持震慑—牢守安全底线
多年来,国家药品抽检通过一定覆盖面的抽检规模,对不合格产品查控和信息公开、对风险线索核查处置,对药品从业主体形成了强烈震慑,强化了药品全生命周期和全过程质量控制的意识。
2018~2021年,国家药品抽检总合格率呈稳步上升趋势,公众用药安全得到有效保障。除生物制品每年合格率均在100%以外,各类别(化学药品、中成药、中药饮片)合格率也都保持上升趋势。例如中药饮片,国家药品抽检总合格率从2017年的89.7%,提升至2021年的98.4%,随着持续加强中药饮片专项抽检及信息公开监管力度加大,产业存在趋向优势集中的态势。
近五年来,通过抽检等监管举措的不断实施和强化,药品质量总体安全形势平稳可控,药品质量处于较高水平,市场环境持续向上向好,药品抽检对守住我国药品质量安全底线至关重要。
(二)深入排查—查控假劣药品
2021年,国家药监局依照“风险控制-依法处置-排查原因并整改-信息公开”的监管模式,确保风险关闭、警示用药安全。组织各省级药品监管部门对国家药品抽检发现的70批次不符合规定产品,在第一时间采取了查封扣押、暂停销售使用、要求企业主动召回等风险控制措施;对涉及的相关企业和单位均依法组织查处;同时要求药品生产企业认真排查,督促其查找问题原因并切实整改,确保质量安全隐患得到及时有效清除。通过药品抽检严厉打击了制售假劣药品的行为,发挥了震慑不法企业、净化市场环境的作用。此外,国家药监局在2021年共发布药品补充检验方法12个,为打击隐蔽性极强的掺杂掺假等违法行为提供了监管利器,也为企业提供了保障药品质量安全的科学依据。
(三)监检结合—打击违法违规
根据国家药品抽检探索性研究结果发现的风险线索,对经检验合格但涉嫌存在违法违规行为的,药品监管部门及时开展现场检查,并根据检查结果采取相应的监管措施控制系统性风险,严厉打击个别企业存在的违法违规行为。例如探索性研究发现部分批次麝香壮骨膏涉嫌存在人为投料错误或非法添加麝香草酚等问题,经检查发现个别企业存在生产质量管理安全隐患,物料交叉感染,投料原料未全检验等问题。通过抽检与检查、稽查执法等工作有机衔接,形成高效协同的监管合力,个别企业逃避监管的违法违规的企图得到有效遏制,质量安全意识逐步增强。
(四)风险提示—推动产业升级
对于探索性研究发现的安全风险较低、非主观故意且未涉嫌违法违规的一般性风险信息,药品监管部门对相关企业进行风险提示,督促指导相关企业对可能存在的质量风险因素进行深入排查、认真整改。例如,在探索性研究中发现部分批次小儿肺热宁胶囊易氧化成分含量下降较明显,提示聚酯/铝/聚乙烯药用复合膜包装材料对氧气的阻隔性能会影响此类制剂的质量;部分批次止咳桃花散的包装材料对麝香酮的吸附率高达85%,不适用于止咳桃花散的包装;部分批次奥利司他胶囊同一批次不同包装间药品质量存在差异及内容物颗粒粘黏胶囊壳的情况,存在生产工艺不合理或控制不到位等问题。企业就风险提示开展排查、分析和验证,采取优化生产工艺、提高内控标准、加强原辅包质量控制等整改措施,提升产品质量水平。
(五)社会共治—助力科学监管
国家药监局继续以通告的形式,依法及时向公众发布不符合规定产品信息,筑牢公众用药安全防线,全年共发布药品质量通告5期。中检院持续在官方网站公开国家药品抽检的探索性研究情况,2021年共发布102个品种的新建检验方法、承检机构及联系方式等内容,这种寓服务于监管的模式,有利于促进上市持有人的质量安全意识和主体责任自律意识,通过信息的共享利用,针对发现的药品质量问题和检验检测新技术进行交流,促进产品研发创新升级。
依托国家药品抽检结果,2021年9月,“药品质量安全年会”以线上形式举办,搭建检验检测生产研发机构信息交流平台,分析检验检测数据,挖掘质量安全问题,助推药品产业发展提质升级,成为行业内获取药品质量提升信息的重要渠道之一。
四、结语
2021年国家药品抽检工作顺利完成。检验及研究结果显示,我国药品质量仍处于较高水平,整体安全形势平稳可控。
2022年是“十四五”规划的起步之年,正值向着全面建成社会主义现代化强国的第二个百年奋斗目标迈进的重大历史关头。人民药监初心如磐,国家药监局将继续坚持人民至上、保障用药安全有效、助力保障疫情防控大局,不断推进药品抽检制度体系现代化,健全完善药品抽检模式,大力发展监管科学和智慧监管,多措并举提升技术支撑能力,坚决守住药品安全质量底线,助力产业高质量发展。
小贴士
1.药品抽检历史沿革
1956年,我国首次提出药品计划抽检的概念;1964年,原卫生部第一次制定国家级年度药品抽检计划并组织实施;1984年颁布《中华人民共和国药品管理法》,第一次从法律上明确了药品抽检工作的地位;1986年,实行药品质量公报制度;1990年,实行药品抽检收费制度,即抽检药品须由被抽检单位付检验费;2001年,《中华人民共和国药品管理法》修订,取消了药品抽检收费制度,所需费用由财政列支;2019年,《中华人民共和国药品管理法》再次修订,明确“药品监督管理部门根据监督管理的需要,可以对药品质量进行抽查检验”“抽样应当购买样品”。
2.药品标准检验
药品标准检验是指具有检验资质的药品检验机构,依据国家药品监督管理部门批准的法定检验标准中的检验方法,进行全项目或部分项目的检验,并依法出具检验报告书的过程。
3.探索性研究
探索性研究是指在国家药品抽检过程中,除按照国家药品标准进行检验并判定药品是否符合标准规定之外,针对可能存在的质量问题,应用该品种国家药品标准以外的检验项目和检测方法对药品质量进行进一步分析研究的过程。探索性研究结果不作为判定药品合格与否的依据,可为进一步提升药品质量水平、加强药品监管提供技术支持。
4.国家基本药物
国家基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。国家基本药物目录是各级医疗卫生机构配备使用药品的依据。《国家基本药物目录(2018年版)》中的药品包括化学药品和生物制品、中成药、中药饮片3部分,其中,化学药品和生物制品主要依据临床药理学分类,共
417个品种;中成药主要依据功能分类,共268个品种;中药饮片不列具体品种,颁布国家标准的中药饮片为国家基本药物,国家另有规定的除外。
5.药品补充检验方法
药品补充检验方法和检验项目(药品补充检验方法)适用于有掺杂、掺假嫌疑,且国家药品标准规定的检验方法和检验项目不能检验的药品检验。经国务院药品监督管理部门批准后,使用补充检验方法和检验项目所得出的检验结果,可以作为药品监督管理部门认定药品质量的依据。
6.检验项目
性状项下记载药品的外观、臭、味、溶解度以及物理常数等,在一定程度上反映药品的质量特性。
鉴别项下规定的试验方法,系根据反映该药品的某些物理、化学或生物学等特性所进行的药物鉴别试验,不完全代表对该药品化学结构的确认。
检查项下包括反映药品的安全性与有效性的试验方法和限度、均一性与纯度等制备工艺要求等内容;对于规定中的各种杂质检查项目,系指该药品在按既定工艺进行生产和正常贮藏过程中可能含有或产生并需控制的杂质(如残留溶剂、有关物质等);改变生产工艺时需另考虑增修订有关项目。
含量测定项下规定的试验方法,用于测定原料及制剂中有效成分的含量,一般可采用化学、仪器或生物测定方法。
附表:2021年国家药品抽检品种目录

(来源:中国食品药品检定研究院)