免疫动态平衡的维持涉及宿主和微生物群之间的协同关系。典型干扰素(IFN)信号通过STAT1转录因子的参与控制对急性微生物感染的反应。然而,在没有急性感染的情况下,紧张性水平的干扰素对免疫稳态的贡献在很大程度上仍未被探索。作者报道STAT1 KO小鼠自发发生炎症性疾病,其特征是骨髓增生和造血干细胞脾脏聚集。此外,这些动物还患上了炎症性肠病。对肠道细菌的分析显示,在缺乏强行性IFN信号的情况下,存在严重的生态失调,从而触发TH17细胞的扩张和脾脏Treg细胞的丢失。通过抗生素治疗减少细菌负荷避免了TH17偏倚,阻断IL17信号通路防止了髓样扩张和脾脏干细胞聚集。因此,补益性干扰素调节肠道微生物生态,这对维持生理免疫稳态和预防炎症至关重要。免疫动态平衡的维持涉及宿主和微生物群之间的协同关系。典型干扰素(IFN)信号通过STAT1转录因子的参与控制对急性微生物感染的反应。然而,在没有急性感染的情况下,紧张性水平的干扰素对免疫稳态的贡献在很大程度上仍未被探索。作者报道STAT1 KO小鼠自发发生炎症性疾病,其特征是骨髓增生和造血干细胞脾脏聚集。此外,这些动物还患上了炎症性肠病。对肠道细菌的分析显示,在缺乏强行性IFN信号的情况下,存在严重的生态失调,从而触发TH17细胞的扩张和脾脏Treg细胞的丢失。通过抗生素治疗减少细菌负荷避免了TH17偏倚,阻断IL17信号通路防止了髓样扩张和脾脏干细胞聚集。因此,补益性干扰素调节肠道微生物生态,这对维持生理免疫稳态和预防炎症至关重要。
干扰素(IFN)是天然免疫和获得性免疫的重要介体。干扰素一般由三类细胞因子组成:由多种基因编码的Ⅰ型干扰素家族,主要包括多种干扰素-α亚型和干扰素-β;Ⅱ型干扰素家族,其中干扰素-γ是其唯一成员;Ⅲ型干扰素家族由几个干扰素-λ组成,每个干扰素家族通过一个不同的异源二聚体细胞表面受体传递信号。
干扰素-I的所有成员都结合一个称为IFNAR的受体,该受体触发JAK激酶JAK1和Tyk2的激活,该激酶介导信号转导和转录激活因子(STAT)家族的两个成员STAT1和STAT2的酪氨酸磷酸化。活化的STAT1和STAT2,连同干扰素调节因子(IRF)9,形成异三聚体复合物ISGF3,与数百个干扰素刺激基因启动子中干扰素刺激的反应元件结合。当IFN-III与由IL28Ra和IL10Rb亚基组成的不同受体结合时,这个信号级联也激活ISGF3,并与IFN-I下游的通路大部分重叠。相反,IFN-II在结合其同源受体(IFNGR)后,主要通过STAT1的同源二聚体发出信号,并刺激一组含有γ激活序列(GAS)的基因。所有这些途径都集中在STAT1上,STAT1缺乏或功能低下会导致对所有类型的干扰素都不敏感。正如预期的那样,人类STAT1缺陷导致对病毒和分枝杆菌感染的易感性增加,造血细胞移植仍然是唯一的治疗方法。
缺乏STAT1的患者在缺乏对微生物的适当先天免疫反应的情况下无法茁壮成长,这就排除了对STAT1在体内平衡中的贡献的研究。然而,一些STAT1部分功能丧失(LOF)的患者患有慢性结肠炎,以及严重的感染。另一方面,STAT1功能增强(GOF)突变的个体最常患粘膜皮肤疾病,部分原因是TH17细胞水平降低,从而将重要的调节功能归因于STAT1。
尽管参与了相似的下游信号级联反应,但越来越明显的是,干扰素-I和-III在建立对微生物的先天免疫中扮演着不同的角色,并以不同的方式参与宿主的整体免疫功能。例如,干扰素-III已被证明通过减少产生IL-17的TH17辅助T细胞的数量和限制中性粒细胞的招募来消炎。有趣的是,除了其在炎症中的重要作用外,IL-17还在造血中起重要作用。例如,IL-17刺激髓系和红系祖细胞,提示IFN-III可能通过限制IL-17的作用而在造血调节中发挥作用。此外,部分由于其受体的分布较为有限,IFN-III成员显示出一种独特的能力,在黏膜部位对抗病原体入侵,同时抑制过度炎症,有助于保持屏障的完整性。
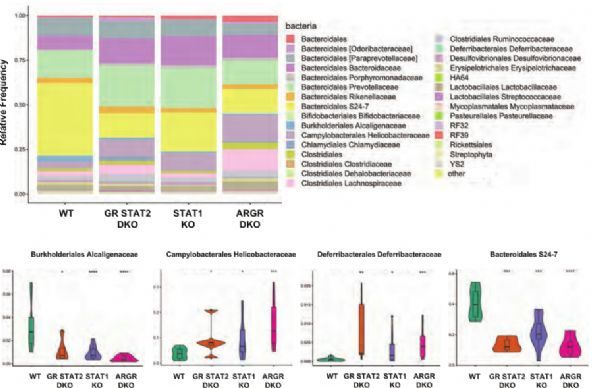
越来越多的证据表明,存在于粘膜表面的共生肠道微生物区系在塑造宿主免疫系统方面也起着重要作用。然而,对微生物组和IFN之间相互作用对预防发病机制的重要性的理解有限。在这里,作者揭示了STAT1在控制微生物生态中的作用,该微生物生态可防止炎症并在没有感染性挑战的情况下维持免疫稳态。该研究表明,通过其共同介质STAT1起作用的通过IFN途径的强直信号传导是免疫稳态的必需调节剂,降低了炎症倾向。这种强直性IFN信号似乎涉及所有三个主要的IFN家族,因为通路的所有三个分支的缺失是完整的炎症表型所必需的。缺乏紧张性干扰素信号可以形成扭曲的微生物群,从而触发炎症反应,这可能是由于TH17细胞对致病表型的偏向增加,以及外周Treg的归巢或存活受损所致。
(来源:生物谷)