GMP细胞治疗产品附录(征求意见稿)列出的6项细胞产品的特殊性:供者材料的安全性、生产工艺的特殊性、生产批量小、温度敏感、易受污染或交叉污染、易产生混淆和差错,基本都对细胞治疗产品生产企业(以下简称企业)在厂房设计及生产管理策略方面提出了较高的要求。

细胞治疗行业的另一大特性是靶点更新快,技术更新快。靶点更新快代表着品种多,技术更新快,代表生产工艺更新换代快。如亘喜生物的FasTCART平台和TruUCART平台,可能针对同一把靶点开发不同产品。又比如,针对BCMA和CD19 各自单靶点和双靶点的产品。企业不可能也没有必要针对不同靶点,不同工艺专门建生产车间,这就注定产品在制备过程中存在多产品共线的可能性。
结合《药品生产质量管理规范》、《药品共线生产质量管理指南》、《药品生产质量管理规范-细胞治疗产品附录》、《免疫细胞治疗产品药学研究与评价技术指导原则》,细胞治疗产品在多产品共线生产的情况下,企业应当考虑的因素以及应该采取的管理措施如下。
细胞治疗产品共线情况描述
现目前国内的细胞治疗企业,随着近几年CDMO企业的兴起,MAH制度的提出进一步支持,部分企业仅建立细胞制剂生产线,质粒和病毒均为外购。还有部分企业则分别针对质粒、病毒和细胞制剂建立生产线。无论是企业自身,还是CXO系列公司,产品制备车间主要存在以下情况:
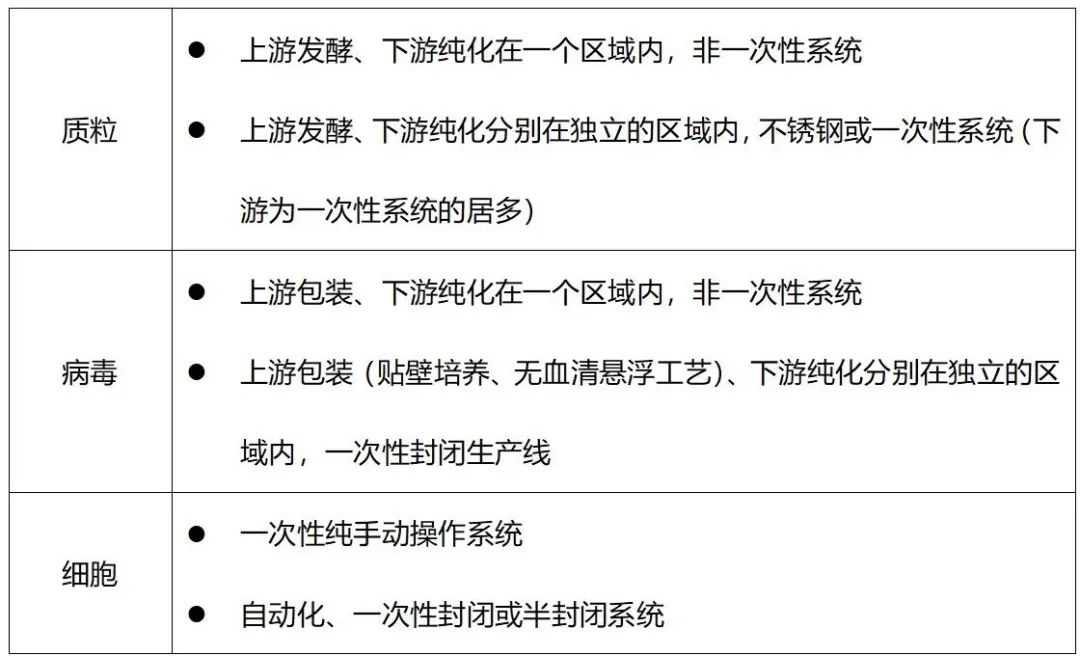
CXO系列公司在生产线的配备上相对完备,针对质粒和病毒分别有一条或多条生产线,部分企业同时配备一条非一次性和多条一次性生产线。尽管如此,也避免不了多产品共线的情况。
比如质粒,目前绝大多数慢病毒包装采用4质粒系统,1个目的质粒和3个包装质粒,增加一个靶点需增加一个质粒。病毒也是如此,增加一个靶点就增加一个病毒(品种)。如果在工艺上不存在大的差别,比如均为贴壁工艺或悬浮工艺包装的慢病毒,大概率会共线生产。细胞制剂也是如此,如果不同靶点之间的工艺差别不大,势必存在共线生产的情况。
细胞治疗产品-多产品共线需考虑的因素
药品生产中产生污染和交叉污染的途径主要包括残留、机械转移、空气传播、混淆。
残留是交叉污染的主要途径, 残留物包括清洁后的设备内表面残留的物料、产品、 降解产物、清洁剂等。残留主要针对非一次性使用系统,残留物需要依靠清洁进行去除,在设备设计、使用、清洁、维护等方面均需要相应的控制措施。残留在细胞治疗产品上则更多考虑质粒的生产、部分病毒载体的生产。
机械转移包括物料从受污染的非产品接触表面转移到产品中的所有可能的途径,需要在人、机、料、法、环各个方面加强管理,设计合理的人流、物流流向,严格的物料管理要求等,尤其在品种转换方面,对更换品种的顺序进行充分评估并明确规定。
空气传播是指产品或物料产生稳定的气溶胶移动至其它产品区域,并在该区域大量沉积在另一个暴露的产品上,导致产品的交叉污染。非封闭性设备容易产生这一类污染,需注重设备设施、厂房设计、空调系统方面的管理。针对一次性系统而言,机械转移和空气传播是产生污染和交叉污染的主要途径。
细胞治疗产品的共线生产不可避免,但确需共线时,还应进行全面考虑。具体考虑因素如下:
01 多产品共线应有相应的评估报告
持有人和药品生产企业应当按照法律法规要求,综合考虑药品的特性、生产过程、预定用途、厂房设施与设备等因素,评估多产品共线生产的可行性,并形成共线生产可行性报告。
02 拟共线品种的特性
品种特性主要包含产品类别、毒性、活性、致敏性、溶解性、活性微生物、性状、物质状态等。一般情况下,不同质粒共线、不同病毒载体共线以及不同靶点细胞制剂共线,在溶解性、性状、物质状态等理化性质方面基本无差异,而在毒性、活性、致敏性等方面,细胞制剂可能存在轻微差别。
03 生产工艺的特性
质粒、病毒载体和细胞制剂均可视作非最终灭菌制剂,一般可进行共线生产的品种,在生产工艺上的差别也较小。比如细胞制剂一次性纯手动生产工艺和自动化全封闭工艺则相对较难实现共线生产。一方面,生产设备大,手动生产主要生产设备为生物安全柜、二氧化碳培养箱、离心机等,自动化封闭生产工艺主要生产设备为Sepax C-Pro、Xuri(WAVE)等。此外,生产环境洁净度要求也有所不同,纯手动生产需在B+A环境下,半封闭设备在C级环境下,全封闭设备则可在D级环境即可。
04 预定用途
质粒和病毒在给药途径、临床适应症、用药禁忌配伍禁忌及联合用药情况、用药对象、剂量、是否长期用药等方面差异均较小。细胞制剂的给药途径基本一致,目前基本都为一次性给药,也不存在长期用药的情况。
05 厂房设施设备共用情况
如前文描述,根据实际共线情况进行具体分析。如过采用的非一次性系统,比如质粒发酵为不锈钢发酵罐,则需重点考虑设备的清洁验证。如所有设备均采用一次性系统,则应重点考虑一次性抛弃系统需确认密闭性,空调净化系统如风管、过滤器等的处理措施,设备状态标识信息等。
06 不同药物不同阶段共线
临床试验中的试验药物其药理毒理信息可能尚不全面和充分,与商业化药品共线生产时,存在未知风险。因此早期临床试验用药物的生产尽可能使用专用或独立的生产设施设备、一次性生产系统或采用阶段性生产、清洁确认相结合方式;临床试验用药物和其他临床试验用药物共线生产时, 在对临床试验用药物特性基本了解的基础上,采取必要的预防措施,如阶段性生产、一次性生产系统等方式,避免临床试验用药物相互之间的污染和交叉污染,确保共线生产产品的安全性,且每批临床试验用药物生产结束后需进行清洁效果确认。
07 生物安全性
考虑新引入物料、产品是否带来生物安全性风险,如TSE/BSE声明、菌毒种污染等。
08 活体物质
在细胞产品制备的各个环节均存在活体物质,且生产条件均有利于微生物的繁殖。因此,如果环境清洁不彻底,产生污染风险的可能性极大。同时,如果上批次生产后清洁不彻底,活性物质也存在引起的交叉污染的风险。比如上批生产A质粒的菌种混入下批生产B质粒的菌种中。活体物质易繁殖或复制,生产后应灭活和清洁,灭活和清洁的效果应当经过确认。
09 清洁程序
生物制品的清洁程序通常为强酸碱或高温(60~80℃),该条件下蛋白易变性或降解,此类情况可找其它具有代表性的参数进行确认。
细胞治疗产品-多产品共线可以采取的管理措施
01 采用阶段性生产方式
质粒生产避免在同一空间内同时生产两种质粒,一条生产线一次只能生产一种病毒,一个空间一次也只能生产一种病毒,同一个空间尽可能每次只生产一个细胞批次(如使用密闭系统进行细胞培养的情况除外)。
02 采用一次性密闭系统生产
同一生产操作间内有多个隔离器,应当定期对其进行完整性检查,隔离器不应直接向操作间内排风,且排风不可循环利用。还应采取有效的措施避免物料、产品和废弃物的差错和混淆,如密封转移、交替操作、定置管理、灭菌与消毒以及单向流传递等。
同一生产区域内采用密闭系统进行同一品种不同批次细胞产品生产的,除细胞培养步骤外应避免在同一生产操作间内同时进行多个相同或不同步骤的生产操作,在完成一个步骤生产操作后应及时进行清场。
03 清洁方法经过验证(包括厂房和设备的清洁)
采用经过验证或已知有效的清洁和去污染操作规程进行设备清洁;必要时,应当对与物料直接接触的设备表面的残留物进行检测。每次生产结束后需进行清场,生产结束后的环境清洁应当考虑对空调系统如风管、过滤器等的处理措施,采用经验证的标准程序进行清洁及消毒处理。每次生产操作前,对清场情况进行确认。
04 有效的预防措施
采用密闭系统进行细胞培养,同一生产操作间或同一培养箱内可同时培养和保存不同批次产品,但应当采取有效措施避免混淆;采用非密闭系统进行细胞培养,应对培养箱内不同批次产品进行物理隔离(如采用蜂巢式培养箱)或采用不同生产操作间的独立培养箱,培养箱内应保持一定的洁净度且可以进行消毒或灭菌。还应进行充分的风险评估,采取有效措施以避免交叉污染和混淆;
同一生产区域内的多个生物安全柜,分布于不同生产操作间,宜采用密闭系统同时进行同一品种不同批次细胞产品的生产;如无法保证全部生产过程的密闭控制,则应充分进行风险评估,并采取有效的措施避免物料、产品和废弃物的差错和混淆,如密封转移、房间压差控制、不得跨越房间操作、人员不得交叉走动、灭菌与消毒以及单向流传递等;
密闭系统或设备发生意外开启或泄漏的,应当进行风险评估并采取有效的应急措施。
05 可追溯性
确保生产全过程样品和生产物料(包括从细胞/组织采集过程、生产、运输到临床应用整个过程)的可追溯性。
06 阳性供体的活体材料
应使用独立的空调系统,专用设备,开口操作区域应保持相对负压。该产品生产区域每次只能生产一个批次的产品(同一供体除外)。
含有传染病病原体的自体供者材料,在生产、转运过程中不得接触其它不含有传染病病原体的供者材料或细胞产品。
(来源:蒲公英)