目前,在一些疾病领域还缺乏适用于儿童的剂型和产品,儿童用药(以下简称“儿药”)短缺已经成为全世界医药行业、药政当局和患者关注的共性问题,即使是在药品研发、生产、监管水平较高的美国,也有超过75%的药品缺少儿药信息,尤其是说明书上缺少明确标注儿童以体重或年龄计算的用法用量,因此药品被不科学地减量给儿童使用已经成为国内外儿童用药的普遍特征。
长期以来,儿药开发及市场价值被严重低估;根据伦敦大学Catherine Tuleu 2017年发表在《药学与药理学杂志》的论文“Better medicines for children: are we there yet?”以及美国俄亥俄州辛辛那提大学Albert Fung等人在2021年底发表在《难治性罕见病研究》杂志上的论文“Off-label medication use in rare pediatric diseases in the United States”相关数据,全球儿童药物市场规模呈逐年上升趋势:2018年全球儿药市场规模约为973亿美元,2019年全球儿药及疫苗市场估值约为1220亿美元,预计于2025年达到1410亿美元。
这种发展趋势也推动了全球医药企业对儿药的研发热情;另一方面,各国政府对儿药政策不断推进、对儿药安全问题的关注以及对儿童专用药的重视,也大大推动了儿药的发展。
美国是儿药立法监管最早的国家,欧盟则是在加强儿药管理及政策扶持方面一直努力的组织,本文就欧美的儿药相关法规及目前全球儿药项目分布进行简单解读和梳理。

欧美政策盘点
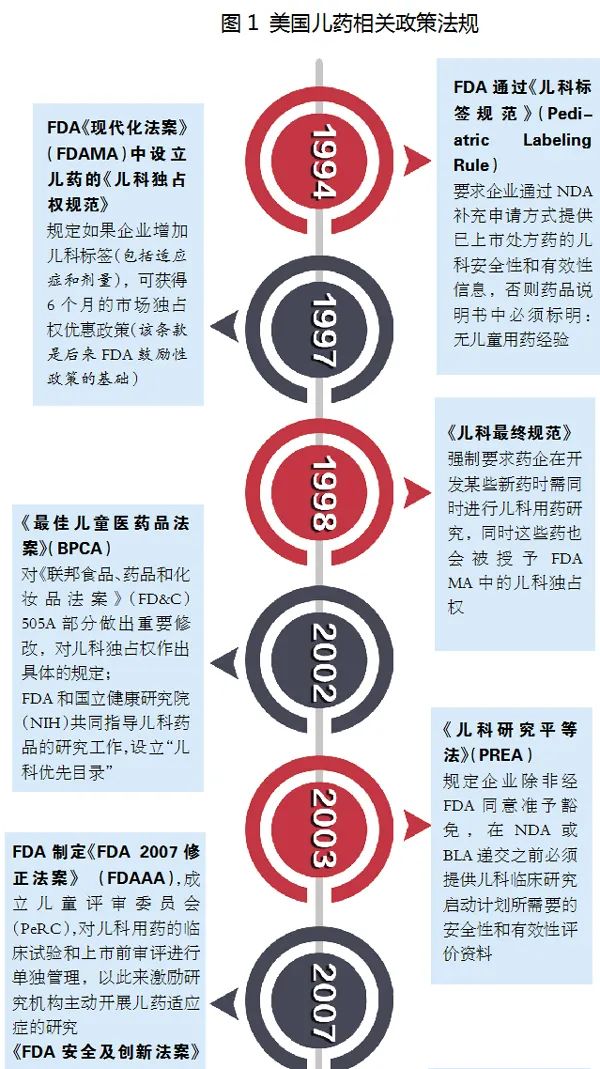
美国是目前全球最大的儿童药物市场,也是制药行业法规体系最健全的国家之一。1979年FDA开始要求药品标签提供儿童使用信息,有成套正规的立法规定儿药的研究,积累了相对成熟的政策法规经验。

自1997年实行儿药《儿科独占权规范》以来,根据FDA官网披露的数据,截至2020年10月,共授予儿药独占权263个。其中2019年授予儿药独占权15个,2020年授予儿科用药独占权6个。且所属的公司基本都是大型药企,小型公司或初创型的公司研发经费不足,一般很难驾驭儿药开发所面临的挑战和困境,这也充分体现了儿药开发的难度。
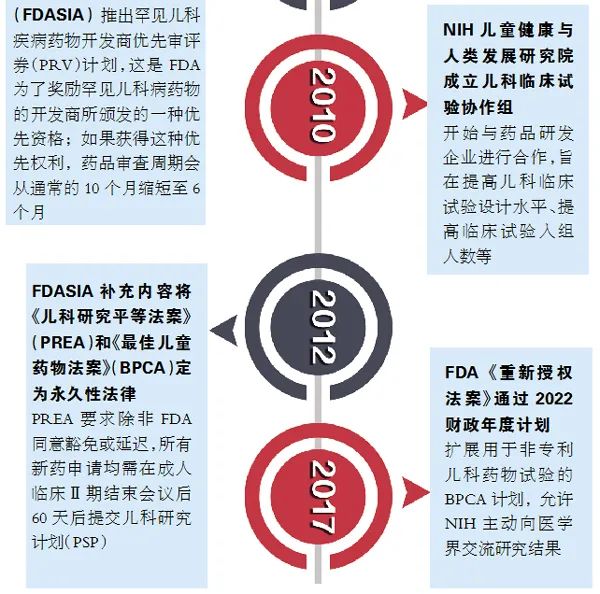
欧盟是儿药的另一个巨大市场,其制药公司的规模及数量不容小觑,在加强儿药管理及政策扶持方面,欧盟一直在努力,1997年,欧盟委员会在EMA组织的一次专家圆桌会议中讨论了儿药的问题,会议认为有必要加强立法并引入儿童药物开发的激励机制,这是欧盟儿药立法的开端。
这里重点剖析《儿科药品管理条例》(Paediatric Regulation),该条例要求从2008年7月26日开始,所有欧洲制药公司推出的新药均需通过儿童临床试验,按照儿科调查计划(PIP)的要求就产品的儿童临床试验进行描述,提供数据资料。
同时EMA专门成立了一个儿科委员会(PDCO),主要负责对PIP的评估,并负责维护欧洲小儿临床研究的网络,制定儿科人群用药的需求一览以及其更新。自2009年1月26日起,新适应症、新剂型、新处方的补充申请也必须包括PIP。根据PIP获得儿药数据的药品,可获得6个月的市场保护期,其中对于治疗罕见疾病的药品,该保护期可延长2年。
另外一方面,根据《儿科药品管理条例》第26条,对于与药品的儿科研发有关的任何问题,EMA均提供免费的科学建议(SA)或协议协助(PA)。这些建议一般由科学建议工作组(SAWP)提出,并由人用药品委员会(CHMP)采纳通过。对于儿科用药研发的请求,儿科委员会(PDCO)的成员通常作为专家通过SA程序提供科学建议。该规定从2009年至今均有执行。
从EMA及欧盟委员会关于儿科用药的行动方案中,我们可以看到其明确的态度及行动计划:确定儿科用药的需求、加强决策者的合作、确保及时完成PIP、改善PIP申请的处置方式、增加儿科药物的透明度。
由此可见,目前欧盟针对儿科用药从立法、技术指南、管理程序、实施路径都已经建立了相对完善的体系。
在研项目分布
尽管各国对儿药监管相关的政策法规制定及实施程度层次不齐,但总体来看在不断进步和完善,并且对儿药的开发持鼓励和支持的态度。在这样的大环境下,儿药的开发势头日益迅猛,种类也更加广泛。
根据Clinical Trials网站数据,目前已经申报临床试验(从尚未招募志愿者到Ⅳ期临床试验)的儿童疾病相关项目有近13000项(区域分布见表2),所处临床试验分期见表3,这些项目涉及的疾病及健康影响原因有约2500多种,其中排在前二十位的疾病种类分布见表4。
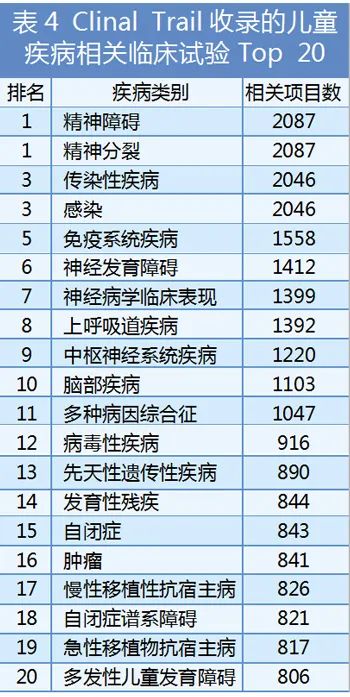
这些数据从多方面、多角度体现了世界范围内儿童药物的研发现状,这种蓬勃发展的趋势既是现行相关政策法规日趋完善的体现,也是督促现行政策法规不断完善的一种动力。
无论是在国外还是国内,要想谋求儿药研发及使用的规范化,结合自身特点及优势,再互相借鉴、互相学习,必要时互相合作才是正途。
相关
与美国和欧盟相比,日本未建立法律法规来强制儿药开发。为此,有学者于2021年利用日本和欧盟之间的儿童适应症批准滞后的信息,调查日本儿童药物开发的现状和特点。
通过对日本2007年1月至2018年12月批准用于儿科适应症的药物进行研究,发现在日本和欧盟,105种儿科适应症药物的审批滞后中位数为1017天(日本滞后)。ATC B类(血液系统用药)和L类(抗肿瘤及免疫用药)的滞后情况在2011年后明显改善;中位数不到半年。通过多区域临床试验在全球开发的药物与区域开发的药物相比,滞后时间明显缩短。
此外,基于欧洲和日本批准用于儿科适应症的药物信息,有学者在2020年评估了日本与欧洲儿药批准的最新状况及其特点。他们的研究纳入2007-2015年两地批准用于儿科适应症的药物。采用ATC分类方法计算儿童适应症药物的占比,并对儿童剂型发展现状进行分析。确定从成人到儿科适应症批准的时间。发现欧洲共有135种药物获批用于儿科适应症,日本获批208种。
在ATC分类为N(神经系统用药)和J(全身使用抗感染药)以及随着儿科剂型的发展,日本有儿童适应症的药物在欧洲批准的儿童适应症药物中所占比例较其他国家低。除成人和儿童适应证同时批准的药物外,日本成人适应症批准到儿童适应症批准最常见的观察周期为12年以上,欧洲为3~6年。这些研究结果表明,日本确实在促进儿童用药的发展,但日本从成人适应症到儿科适应症批准的时间较欧洲长,某些疾病的儿科药物发展缓慢,有进一步改善的空间。
(来源:医药经济报)