近日,国家药监局药审中心发布《2022年度药品审评报告》(以下简称报告),公开了2022年药品注册受理和审评审批的相关数据。本文结合报告,对近年药品注册申请的受理和审评审批情况进行分析。
药品审评审批节奏放缓
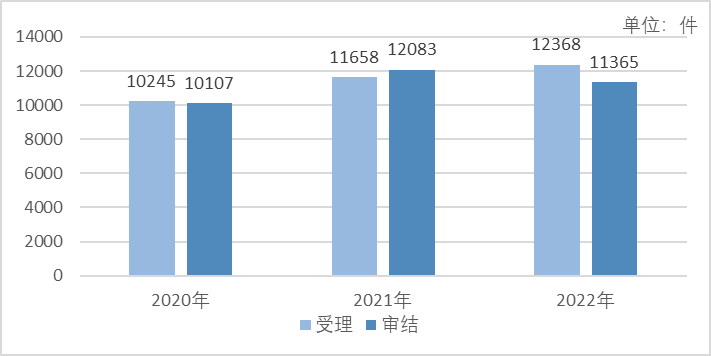
如图1所示,2022年,药审中心共受理药品注册申请12368件,同比增加6.09%,且数量连续三年保持增长。共审结药品注册申请11365件,同比下降5.94%,数量减少主要受到新冠病毒疫情的影响。
图1 2020~2022年药品注册申请受理、审结情况
古代经典名方中药复方制剂实现突破 21种创新药获批
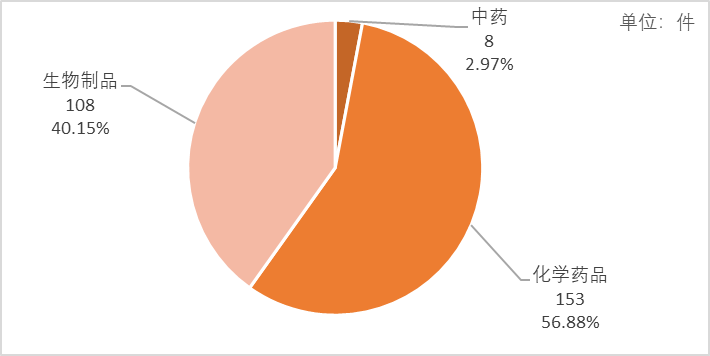
如图2所示,2022年,药审中心建议批准NDA(新药上市申请)共269件,同比减少16.72%。其中以化学药品和生物制品为主,分别批准153件和108件,占比分别为56.88%和40.15%;中药共8件获批,占比2.97%,包括2件古代经典名方中药复方制剂,实现了零的突破。
图2 2022年建议批准NDA药品类型分布情况
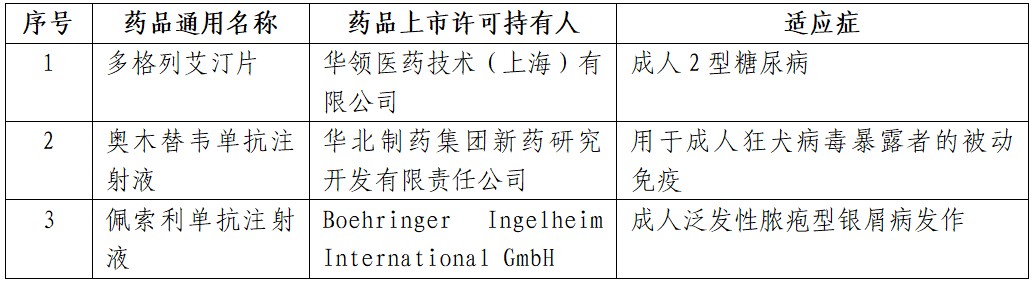
2022年,药审中心建议批准创新药NDA共34件,涉及23个品种。除新增适应症的2种创新药外,共有21种创新药获批。其中,3种为首创新药(First-in-Class),如表1所示。
表1 2022年首创新药
4条通道加快药品上市
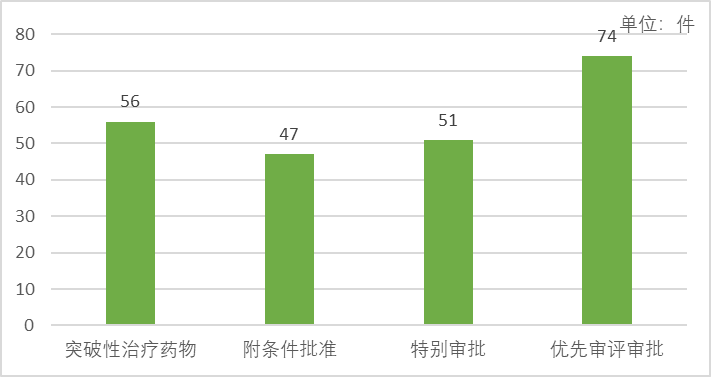
如图3所示,2022年,共56件申请被纳入突破性治疗药物程序,同比增长5.66%,涉及37个品种,覆盖了非小细胞肺癌、多发性骨髓瘤、梗阻性肥厚型心肌病、全身型重症肌无力、宫颈癌等适应症;建议附条件批准47个受理号,涉及31个品种和31个适应症;共51件申请被纳入特别审批程序,均为新冠病毒治疗相关药物;共74件申请被纳入优先审评审批程序,同比减少35.65%,涉及52个品种。
图3 2022年药品加快上市注册程序情况
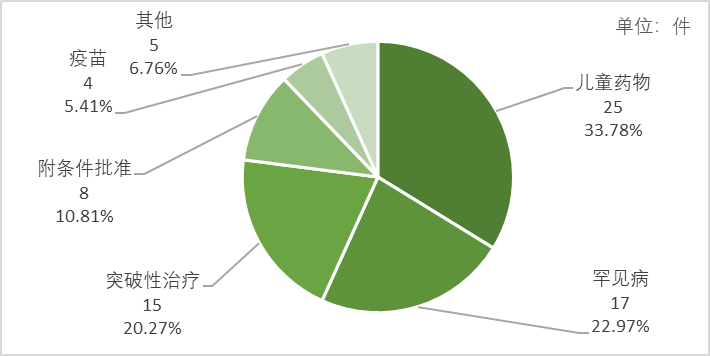
近年来,药审中心优先审评资源逐渐向具有临床优势的新药、儿童用药和罕见病药物注册申请倾斜。如图4所示,在被纳入优先审评审批程序的74件申请中,符合儿童生理特征的儿童用药新品种、剂型和规格25件,占比最高,为33.78%,此外,2022年共有66个儿童用药获批,创历史新高;临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药17件,占比次之,为22.97%;纳入突破性治疗药物程序的药品15件,占比20.27%;符合附条件批准的药品8件,占比10.81%;疾病预防、控制急需的疫苗和创新疫苗4件,占比5.41%。
图4 2022年纳入优先审评审批程序情况
(来源:中国医药报)