原料药或制剂的稳定性[1]是指其保持物理、化学、生物学和微生物学特性的能力。通过设计试验获得原料药或制剂的质量特性在各种环境因素的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和有效期/复检期的确定提供支持性信息。药品的稳定性是满足其临床使用及流通必须具备的特性,也是药品质量研究的重要内容,贯穿于药品的整个生命周期。为规范药品稳定性研究,国内外各监管机构发布了一系列的法律法规和指南,以期引导企业开展良好的稳定性研究,确保稳定性数据能够真实反映药品在储存期间的质量。同时,国内外监管机构在开展药品检查时,也发现了企业在开展稳定性研究时存在一些违反法律法规或指南文件要求的现象。本文旨在通过分析国内外相关法律法规中对药品稳定性研究的要求,结合近年国内外监管机构/组织在检查过程中发现的有关缺陷,为稳定性试验的开展和检查提供参考和借鉴。
1.稳定性研究相关要求
1.1 技术要求
原国家食品药品监督管理总局[ 1 ]、国家药典委员会[2]以及人用药品技术要求国际协调理事会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)发布的指导原则[3]均列举了新原料药及其制剂稳定性试验的主要研究内容,为稳定性研究的开展提供了指导,企业可结合品种特性,参考指导原则的相关要求,设计并开展稳定性研究。
1.2 规范性要求
我国《药品生产质量管理规范》(2010年修订)[ 4 ](以下简称GMP)、欧洲药品管理局(European Medicines Agency,EMA)GMP[5]、药品检查合作计划(Pharmaceutical Inspection Cooperation Scheme,PIC/S)GMP[6]、美国食品药品管理局(Food and Drug Administration,FDA)cGMP(Current Good Manufacture Practices)[7]和世界卫生组织(World Health Organization,WHO)GMP[8]等均针对药品的稳定性研究提出了相关要求。其中我国、EMA和PIC/S的GMP中对稳定性考察的描述较为详细,要求基本一致,FDA和WHO的要求相近,详见表1。

2011年,原国家食品药品监督管理局发布了原料药附录作为GMP的配套文件,ICH Q7活性药物成分的GMP指南/问答也已于2015年12月31日在我国落地实施。我国上市的原料药在开展稳定性试验时,除满足上述要求外,还需符合原料药附录及ICH Q7[9]等的相关要求。
此外,质量管理体系[10]通过对产品的整个生命周期(包括药品研发、技术转移、商业化生产和产品终止等)中影响产品质量的所有因素进行管理,以期为产品的质量提供全面有效的保证。稳定性试验的开展除符合上述技术要求外,还需以企业良好的质量管理体系为基础。
1.3 现场检查相关要求
除上述要求外,国内外监管机构/组织也制定了相应的检查工作程序或合规手册,明确了稳定性的检查范围、要求及风险的判定原则。见表2。

根据《药品注册核查要点与判定原则(药学研制和生产现场)》(试行)[11],稳定性研究及承担该研究内容的机构均是药品注册核查的重点。2022年,美国FDA发布的cGMP 7346.832 批准前检查[12]中也提到了稳定性的要求和核查重点,与我国的《药品注册核查要点与判定原则(药学研制和生产现场)》(试行)基本一致。该合规手册还提出了在检查时应关注异常事件的处理,这些问题通常反映了企业潜在的数据可靠性风险。
2.检查中常见的稳定性相关缺陷
《药品生产现场检查风险评定指导原则》[13]中列举了稳定性考察相关的缺陷,并根据其缺陷严重程度以及产品风险分类,对其风险级别进行了判定。FDA发布的cGMP 7346.832 批准前检查[12]和cGMP 7356.002 药品生产检查[14],也列举了可能存在的稳定性相关的严重缺陷,检查组可基于发现问题的程度,将缺陷项列入483表格,或据此引发官方行动指示(Official Action Indicated,OAI),详见表3。

2.1 我国组织实施的检查
2.1.1 注册核查
通过对国家药品监督管理局食品药品审核查验中心(以下简称核查中心)2020至2022年开展的境内企业化学药品注册核查有关缺陷进行梳理、统计和分析,稳定性研究相关缺陷约占发现缺陷总条款数的6%左右,其中针对研制单位/部门提出的约占36%。涉及条款主要集中在GMP正文第233条、第234条、第238条。此外,占比较高的还包括正文第223条和第250条,主要体现在稳定性试验规程/方案的制定与执行、数据可靠性(实验室异常事件、稳定性试验数据的获得或处理)、稳定性试验设备或设施、检验记录等方面的不足。我国药品注册核查中稳定性相关缺陷占比情况见图1。

(1)稳定性试验规程/方案的制定与执行:GMP(2010年版)正文第234条对稳定性试验方案提出了较强的实操性要求,依据该条款提出的缺陷较多。例如未注明稳定性试验考察项目的可接受标准、检验方法依据或显著差异的判定标准,缺少部分关键检验项目但未给出充分理由。随着注册申报品种的增多,工作量的增加及可能存在的不可抗力等因素的影响,部分企业还存在样品生产完成后未能及时放样,或未按规定的时间点及时取样、检验。此外,药品注册申报期间,质量标准可能会根据审评的要求进行修订,企业应根据质量标准的变更情况评估是否需要修订稳定性试验方案。
(2)数据可靠性:主要体现在数据获得或处理方式不合理(例如未按规定的标准或方法检验、计算或积分不合理)、异常事件的处理不当(例如无故复测、未开展调查、调查不充分或未采取有效的纠正与预防措施)、数据管理存在不足(例如未按规定有效备份、未开启审计追踪、权限设置不合理)等方面。
(3)稳定性试验设备或设施:稳定性试验设备或设施是确保稳定性研究环境符合要求的关键,常见问题集中在持续稳定提供符合要求的考察环境的能力上。ICH Q1A (R2)[3]指出企业应记录设备失控而导致的偏离的影响,如已证明影响稳定性结果,则需报告。以某次现场检查为例,承担稳定性研究的研制单位未对恒温恒湿稳定性试验箱进行温湿度分布验证或校准;每日仅打印记录2个时间点的温湿度,以打印的温湿度数据作为原始数据,但未对已更换的温湿度打印记录条进行保存;稳定性试验箱连续多日出现温湿度异常,但企业的《温湿度巡检记录》显示温湿度均为正常;未明确温湿度异常情况的处理措施。总体上,在人员、设备和管理等多方面不受控。
(4)检验记录:常见的缺陷包括缺少关键原始记录、记录不及时、样品数量与实际不符等。此外,常见的缺陷还涉及人员职责、变更控制、包装、文件管理以及委托研究等。例如未明确稳定性试验相关人员职责(尤其是质量受权人)或履职不充分;未将稳定性试验纳入变更管理,重大变更未列入稳定性考察;试验样品未采用市售包装,再包装后药品缺少有效期确定的依据;委托研究未签订书面协议、申请人/持有人履职不充分、缺少对受托方的审计、未对委托方和受托方检测结果的差异开展分析或调查等。
2.1.2 上市后检查
在对已上市化学药品开展的跟踪检查和飞行检查中,还存在未按规定开展持续稳定性考察、年度回顾时未对稳定性考察的结果及不良趋势进行分析调查或处理,甚至将稳定性考察超标数据记录为合格的严重违反GMP的情形。
2.1.3 境外检查
核查中心近年组织的境外检查中,约三分之一的被检查单位在稳定性研究方面存在不足。例如未针对中国市场的产品开展持续稳定性考察、质量受权人及质量部门负责人的岗位职责中均未包括稳定性考察相关职责、待包装产品稳定性数据不足等。
2.2 FDA 检查中常见的稳定性相关缺陷
检索FDA 2020财年至2022财年签发的药品相关483表格[15],累计分别为349、215、466份,与21CFR 211.137有效期或21 CFR 211.166稳定性试验相关的分别有47条、42条和91条,详见图2。
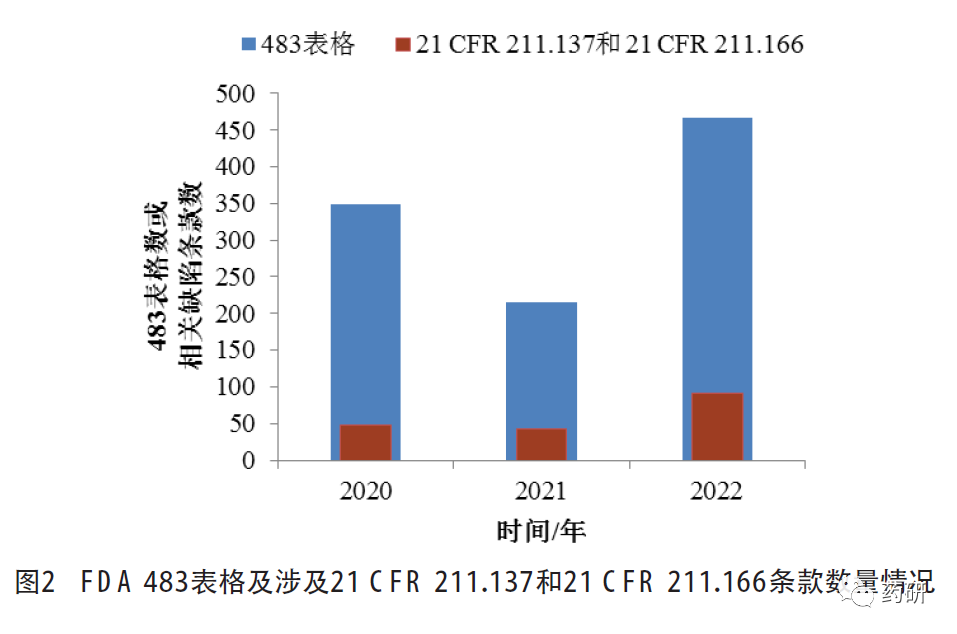
以“stability”为检索词检索FDA 2020至2022年发出的警告信[16],涉及条款除21 CFR 211.137有效期和21 CFR 211.166稳定性试验外,还包括21CFR 211.192生产记录审核(异常事件的调查)、21 CFR 211.22质量管理部门职责(受托单位的监管、变更和人员职责)和21 CFR 211.68自动化、机械化及电子设备(稳定性试验设备或设施)等,详见图3。
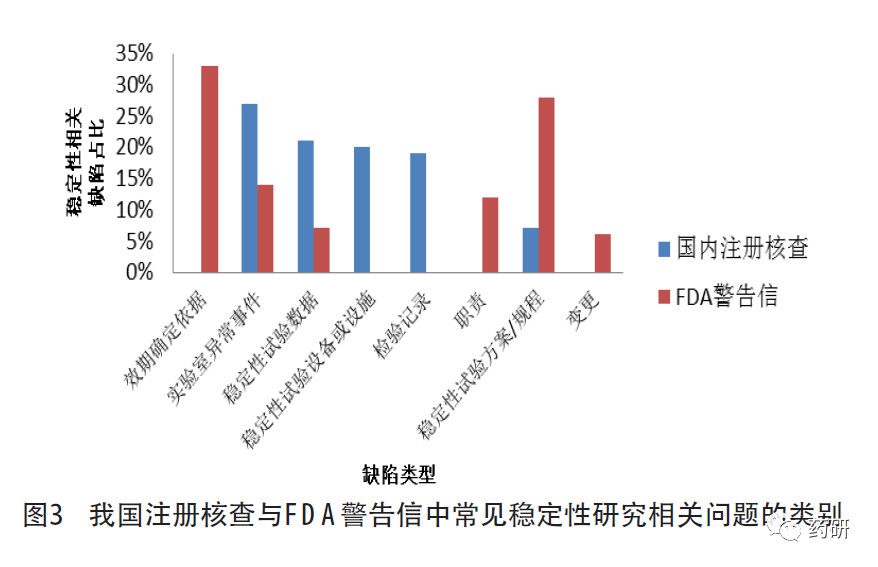
对比我国注册核查与FDA警告信中发现的稳定性试验的相关缺陷,稳定性试验规程/方案的制定与执行不到位、数据可靠性(实验室异常事件、稳定性数据的获得或处理)管理不足均占比较高。我国注册核查中,因委托研制单位开展稳定性研究的占比较高,稳定性试验设备或设施和检验记录方面的缺陷占比较FDA警告信高。与我国注册核查不同,FDA警告信中有效期的确定依据不足、职责未明确方面的缺陷占比较高,这可能与新冠肺炎疫情期间手消毒产品以及美国国内生产的非处方药产品的警告信增加有关。此外,FDA警告信中变更相关的缺陷比例也相对较高,主要与上市后变更相关,即变更后未按要求开展稳定性研究,这与我国已上市化学药品开展的跟踪检查和飞行检查中发现的情况基本一致。
2.3 国外监管机构/组织对我国企业开展的检查
近年来国外药品监管机构包括WHO、FDA、欧洲药品质量管理局(European Directorate for the Quality of Medicines & HealthCare)[17]对我国境内药品生产企业开展的检查中,稳定性相关缺陷占比约为6.9%,主要集中在异常事件的处理、稳定性试验规程/方案、数据可靠性和稳定性试验设备或设施等方面,与我国药品注册核查发现的情况基本一致。此外,同样发现部分企业在变更管理方面存在不足,即未对工艺验证批次、或部分偏差及返工批次开展稳定性试验。
3.案例分析和建议
结合国内外监管机构/组织现场检查常见的稳定性研究相关缺陷,以及我国委托研制单位/部门承担稳定性研究的占比逐渐升高的现状,本文将通过案例近一步分析和讨论稳定性研究中需重点关注的内容。
3.1 案例分析
3.1.1 稳定性试验规程/方案的制定与执行
稳定性试验规程/方案是开展稳定性研究的基础和依据,而良好的执行是获得真实、可靠数据的有力保障。稳定性研究应考察在贮藏期间易发生变化、可能影响其质量、安全性和有效性的项目,考察时间及考察频率也直接影响稳定性结果的统计与判定。以核查发现缺陷为例:某片剂的含量限度为95.0%~105.0%,放行检测含量为103.5%,4个月后放样进行稳定性研究,重新检测的含量为98.2%,超出了申请人确定的显著差异的判定标准。企业在稳定性试验规程/方案中,未明确稳定性0天的放样时间、样品的暂存条件和0天数据的确定依据,在重新检测后,也未对2次检测结果的差异进行调查分析,直接以第2次的含量检测结果作为稳定性0天的数据。ICH Q1A(R2)[2]提到“考察时间,尤其是在注册阶段,可能会影响数据的统计分析,趋势判断,甚至有效期的确定”。在申报过程中,受批次和考察时间的限制,稳定性数据较少,此情况可能掩盖了加速稳定性考察期间含量的变化趋势,不利于有效期的外推或判定。
企业在制定稳定性相关文件时,可根据产品的特性,对稳定性考察时间点(包括起点、试验间隔时间、终点)进行规定,评估并确定可接受的范围,通过风险管理对可能出现的异常情况作出预案。
3.1.2 数据可靠性
《药品注册核查要点与判定原则(药学研制和生产现场)》(试行)指出,稳定性研究所涉及的数据应当能溯源,并完整可靠,方法学验证及之后影响产品质量和稳定性数据评价的研究数据尤为重要。该原则中,多项判定为“不通过”的情形,均与数据可靠性有关。现场检查发现,长期稳定性试验有关物质检测时,有企业直接通过设置禁止积分时间段,将超过质量标准规定的最大未知单杂禁止积分而不报告该杂质,或通过调整积分参数(例如斜率、峰的起止时间)等造成杂质检测数据偏低。这些均提示企业可能存在严重的数据可靠性问题,并反映了企业在质量管理方面的不足。此外,稳定性考察期间出现的异常数据,可能是对样品当下质量或趋势的反映。企业应根据我国GMP和ICH等指导原则的要求,对超标和异常趋势进行调查,并考虑可能对已上市产品造成的影响,必要时应当实施召回,并报告当地药品监督管理部门。在对已上市产品开展的飞行检查中发现,某产品有关物质(最大单杂限度为1.5%)在稳定性考察期间呈上升趋势,其中1个批次的产品最大单杂长期6月(1.3%)和长期9月(1.4%)检测结果已经超出原有考察批次的趋势,且已接近上限。企业未根据历史批次的考察数据对该情况进行对比分析,仍仅以是否符合质量标准要求为判定依据,掩盖了已上市产品的质量风险,不利于及时采取措施。最终长期12月最大单杂检测结果达到限度(1.5%),长期18月检测结果超出标准规定的限度,现场检查提示该企业质量管理系统不能有效运行,不符合GMP的要求。
针对贮藏期间易发生变化的项目,企业可根据产品特性,采取设置警戒限或行动限,缩短试验间隔,增加数据对比方式(例如批内和批间)等措施,必要时重新对工艺进行研究,以便及时发现并捕捉稳定性试验过程中的趋势和异常,确保上市产品符合质量标准的要求。
3.1.3 委托研究
研制单位/部门的出现和介入为药品注册申报提供了很好的技术平台,提高了研发效率,但也带来了新的挑战,尤其是合规性方面。2010年修订的GMP规定,关键人员,尤其是质量受权人,应当了解持续稳定性考察的结果。当持续稳定性考察不在待包装产品和成品的生产企业进行时,则相关各方之间应当有书面协议。部分申请人在委托进行稳定性试验时,并未签订书面协议,或未根据协议对方案进行审批或确认。例如现场检查发现,委托方和受托方签订的稳定性研究委托协议中包括粒度检查项,但受托方的稳定性试验方案中未包括该检项,且委托方未按协议对方案进行审核,以至于未发现该漏检项目。再如,受托单位在对某注射液(三层共挤输液袋装)进行稳定性研究时,工艺验证批0天渗透压为297 mOsmol·kg-1(限度270~320mOsmol·kg-1),长期6月失水率为1.39%,渗透压为306 mOsmol·kg-1,长期9月失水率为2.69%,渗透压为312 mOsmol·kg-1,长期12月失水率为3.20%,渗透压为319mOsmol·kg-1,呈增长趋势,且接近标准规定的上限,受托方未按照协议规定将稳定性研究的相关趋势告知申请人。现场检查期间申请人复测该批次渗透压为304 mOsmol·kg-1,随即采用复测数据作为稳定性研究数据。但现有研究数据表明失水率、含量和渗透压随考察时间均呈增长趋势,申请人和受托单位均未结合品种特性,及已有的数据进行趋势调查和分析,且申请人在委托研究期间也未落实主体责任,根据协议对受托研究单位的资质、能力等情况进行确认及监督。
我国GMP和《药品注册核查要点与判定原则(药学研制和生产现场)》(试行)均对委托研究提出了相关要求。企业可从实验室内部、分析方法(例如方法学验证、方法学转移)、样品及其工艺等方面综合分析,查找原因,并制定管理程序,规范此类问题的判定原则和处理方法。此外,委托研究时还需关注稳定性考察样品的运输和接收,委托方和受托方质量管理文件的兼容性,例如稳定性规程、变更管理规程、实验室异常事件管理规程等,尤其当出现不符合质量标准的结果或重大不良趋势甚至需开展非实验室因素调查时,双方应及时沟通和协调,明确各方职责,确保委托研究机构产生的数据的可靠性,充分落实申请人的主体责任。
3.2 建议
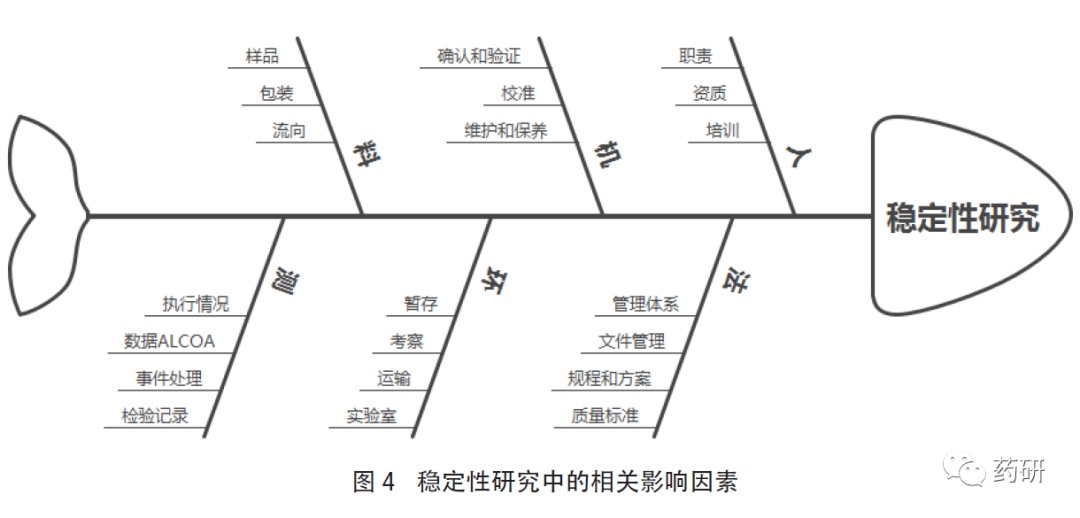
企业应建立标准操作规程去描述稳定性试验的程序和要求,并严格执行,任何偏离发生应启动偏差系统进行调查。企业在开展稳定性试验时,可参考国内外相关指导原则、GMP和《药品注册核查要点与判定原则(药学研制和生产现场)》(试行)等要求,充分评估自身的组织架构和质量管理体系,从人、机、料、法、环、测等多方面综合考虑,做好研究前的准备工作,对可能出现的异常情况进行预判并制定合理的处理措施。同时,根据产品的目标市场,结合品种特性,通过质量风险管理评估制定稳定
4.结语
药品的稳定性是满足其流通及临床使用必须具备的特性,也是药品质量研究的重要内容,贯穿于药品的整个生命周期,对原料药、中间产品及制剂的开发与上市具有重大影响,是制定产品有效期的重要依据。本文对比研究了国内外相关法律法规和指南文件对药品稳定性研究的要求,并对近年来国内外监管机构/组织在各类检查中发现的相关缺陷进行梳理、分析和讨论。企业在开展稳定性研究时,可结合自身质量管理体系情况,对比指南文件的要求和本文中提到的常见缺陷,不断提升改进稳定性研究相关工作的质量。同时,也希望为药品检查工作提供参考和借鉴。
(来源:药研)